Организм представляет собой интегрированное сообщество дифференцированных клеток. Их слаженное функционирование обеспечивается благодаря сложной системе межклеточной коммуникации. Коммуникация предполагает производство сигналов одними клетками, их восприятие другими клетками, а также адекватную их интерпретацию и реакцию на эти сигналы благодаря наличию внутриклеточных сигнальных путей. Неожиданные возможности, выводящие межклеточную коммуникацию на качественно новый уровень, обнаружились при исследовании функциональной роли микровезикул — мембранных пузырьков, повсеместно встречающихся в жидких средах организма и до недавнего времени считавшихся лишь побочным продуктом жизнедеятельности клеток.
Многоклеточный организм, осуществляющий свою жизнедеятельность как единое целое, в то же время представляет собой сложное сообщество из образующих его клеток, обладающих определенной автономностью. Клетки можно рассматривать как конструктивные элементы организма, предназначенные обеспечить правильную его работу как целого. В конечном счете, каждой клетке выгодно и удобно жить в составе сообщества себе подобных. Можно сказать, что в каком-то смысле все клетки организма сообща работают на поддержание каждой индивидуальной клетки.
При таком взгляде возникает соблазн провести параллели с человеческим обществом. Каждый член этого общества выполняет определенную функцию (подобно клеткам тех или иных тканей организма), будучи при этом отнюдь не самодостаточным, а следовательно, нуждающимся в поддержании со стороны всех прочих членов того же общества (организма). Сложность организма, как и сложность человеческого общества, задается степенью разнокачественности, дифференцированности составляющих его клеток, или членов. Слаженная деятельность индивидуальных членов дифференцированного общества требует существования сложных систем коммуникации, которые позволяют взаимно координировать эту деятельность. Именно существование разнообразных способов взаимной координации обеспечивает как общество в целом, так и каждого отдельного его члена возможностью адаптироваться к изменчивым условиям среды. К примеру, во время эпидемии гриппа больной (скажем, рабочий фармацевтического завода) обращается к врачу, способному поставить диагноз и назначить правильное лечение. Врачи побуждают поставщиков фармпрепаратов снабдить аптеки соответствующими лекарствами, поставщики делают заказ соответствующим фармацевтическим заводам, и т. д.
В организме также существуют разнообразные системы коммуникаций, обеспечивающие взаимное координирование деятельности клеток и тканей при адаптации к тем или иным изменениям среды. Широко известны и общепризнанны: 1) коммуникация посредством секретируемых молекул (таких как гормоны, ростовые факторы, нейротрансмиттеры) и рецепторов к ним и 2) коммуникация посредством межклеточных контактов (адгезионных молекул и рецепторов к ним).
Оба эти механизма предусматривают взаимодействие между сигнальной молекулой и связывающей ее молекулой-рецептором, которое должно опосредовать запуск определенной цепочки последовательных реакций (signal-transduction chain) в соответствии с генетически обусловленной программой. Такой тип коммуникации можно уподобить отдаче/приему команды, предполагающей реакцию в виде стереотипного набора действий (пусть даже очень сложного). Так, повышение в крови концентрации инсулина, выделяемого клетками поджелудочной железы, означает для мышечной и жировой тканей команду к откачке из крови глюкозы, для клеток печени — команду к активации синтеза гликогена, и т. д.
Всегда ли такого типа коммуникации будет достаточно для самоподдержания организма в сложной, изменчивой и зачастую непредсказуемой среде? Возвращаясь к аналогии с обществом, можно предположить, что не всегда. В частности, такой механизм не предусматривает возможности поиска и распространения среди себе подобных принципиально нового эффективного решения при необходимости адаптации к неожиданным стрессовым факторам.
Что может быть альтернативой для клеток организма? Теоретически, клетки могли бы отдавать друг другу более конкретные и детальные инструкции, передавая и принимая непосредственно информационные молекулы, каковыми являются мРНК, а также разнообразные молекулы — регуляторы метаболизма и активности генов, в частности транскрипционные факторы, ферменты и микроРНК.
Среди известных типов межклеточной коммуникации, предполагающих такой обмен крупными молекулами и даже целыми органеллами, можно назвать щелевые контакты, формирующиеся между клетками эпителия. Но возможно ли подобное общение между клетками, находящимися на расстоянии друг от друга или даже относящимися к разным типам тканей? Авторы обсуждаемой статьи отвечают утвердительно.
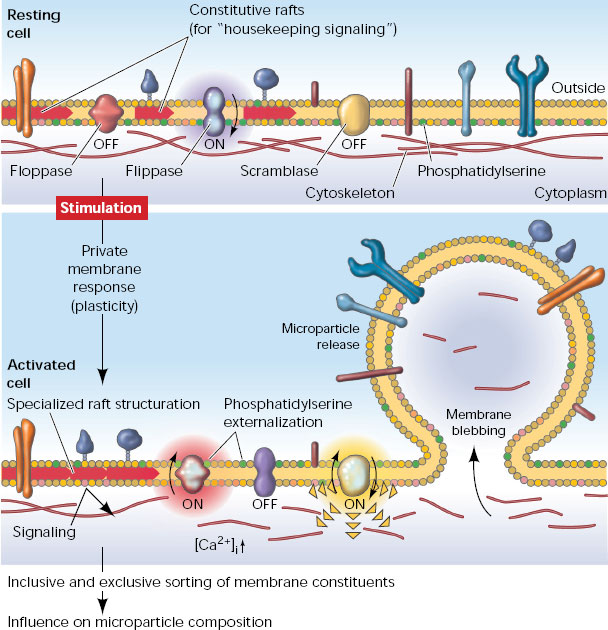
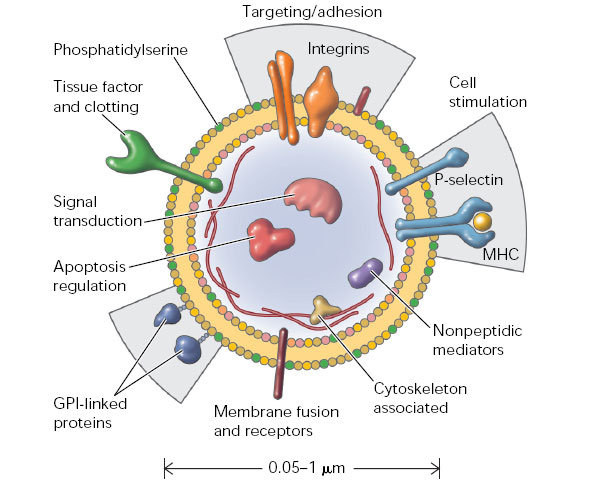
В последние 10 лет внимание ученых было привлечено к обнаруживаемым в разнообразных биологических жидкостях (включая плазму крови, межклеточную жидкость, плевральную жидкость и др.) мембранным везикулам размером от 30 нм до 1–4 мкм. Об их существовании вообще-то было известно давно, но вплоть до недавнего времени их рассматривали как клеточный дебрис — побочный продукт апоптоза, не несущий функциональной нагрузки. Однако исследования последних лет показали, что такие структуры (упоминаемые в разных источниках как «микровезикулы», «микрочастицы», «эктосомы» и «экзосомы») испускаются нормальными, жизнеспособными клетками самых разных тканей организма. В одних случаях их производит наружная мембрана клетки, образующая выпячивания («эктосомы», d = 0,1–4 мкм), в других случаях они высвобождаются путем экзоцитоза из мультивезикулярных телец, образующихся из эндоцитозных пузырьков («экзосомы», d = 30–100 нм). При этом продукция микровезикул усиливается при патологии ткани in vivo и при стрессовом воздействии на клетки in vitro.
Под патологией ткани подразумеваются разнообразные воспалительные процессы, вызванные инфекцией или чем-либо еще, злокачественные опухоли и т. п. Например, при заболеваниях почек в крови и даже в моче будут обнаруживаться микровезикулы, содержимое которых при анализе на белки и РНК укажет на то, что они были «высланы» именно тканью почек (как будто они высылают призыв о помощи). В норме таких микровезикул будет обнаруживаться гораздо меньше, и состав их содержимого будет несколько иной.
Особенностью этих структур является экспонирование на внешней поверхности фосфатидилсерина. Анализ содержимого микровезикул показал, что они включают в себя целые молекулы мРНК, белки, регуляторные микроРНК, а в их мембрану встроены рецепторные белки. Конкретный состав зависит от ткани, производящей микровезикулы, и от функционального состояния этой ткани. Существует база данных (см. ExoCarta), описывающая белки и РНК, обнаруживаемые в микровезикулах разного происхождения. Выяснилось, что производство клетками микровезикул энергозатратно, регулируемо (в частности, зависит от поступления в клетки ионов кальция) и требует участия специальных белковых молекул. По-видимому, имеет место сортировка молекул, заключенных в микровезикулы, так как их концентрации и количественные соотношения в цитоплазме клеток и в производимых клетками микровезикулах не эквивалентны друг другу. Можно предположить, что часть молекул РНК производится исключительно на экспорт, так как они практически полностью оказываются сконцентрированы в микровезикулах.
Все эти факты наталкивают на предположение, что эти структуры выполняют некую функциональную роль, связанную с межклеточной коммуникацией. По своей форме и содержанию они очень напоминают липосомы, используемые в генной инженерии для доставки в клетки тех или иных молекул. Чтобы подтвердить возможность влияния тканей друг на друга, опосредованного микровезикулами, ученые поставили следующий эксперимент. Мыши подвергались облучению 500 сГр (сантигрей), стимулируя таким образом стрессовую реакцию. Затем ткани легких, мозга, печени и сердца облученных мышей переводили в культуру на искусственную питательную среду. После недельного культивирования клетки отделяли, а полученную кондиционную среду использовали в дальнейшей работе.
Из кондиционной среды выделяли микровезикулы (центрифугированием с ускорением 100000g на протяжении 1 часа при температуре 4°), которые затем отмывали и ресуспендировали в искусственной питательной среде, используя полученную суспензию как среду для культивирования клеток костного мозга. Состав РНК в клетках костного мозга проводили через неделю культивирования в присутствии либо в отсутствие микровезикул.
Исследователи провели количественный ПЦР-анализ мРНК 14 генов, из которых шесть специфичны для легочной ткани, три — для головного мозга, три сердечных и два печеночных гена. Оказалось, что состав мРНК микровезикул хорошо отражает их тканевое происхождение. В то же время обнаружилась положительная зависимость между присутствием тканеспецифичных мРНК в микровезикулах и изменениями в количестве тех же мРНК в клетках костного мозга, культивируемых в присутствии микровезикул, по сравнению с клетками костного мозга, культивируемыми без добавления микровезикул. Причем в клетках повышенный уровень экспрессии определенных мРНК сохранялся на протяжении трех недель наблюдения. В случае предварительной обработки микровезикул рибонуклеазой количество соответствующих мРНК как в микровезикулах, так и в культивируемых в их присутствии клеток костного мозга, оказывается намного ниже, чем без такой обработки. В своей более ранней работе авторы показывали, что изменения в содержании определенных РНК сопровождались соответствующими изменениями в содержании кодируемых ими белков в клетках костного мозга. Также наблюдались изменения и в морфологии клеток.
В части экспериментов микровезикулы подвергались предварительному двойному окрашиванию — зеленым флуоресцентным красителем CFSE и красным PKH26, используемыми соответственно для окрашивания цитоплазматической компоненты и мембран таких частиц. Это позволило выяснить, как часто происходит включение микровезикул в сокультивируемые клетки. Двойное окрашивание обнаруживалось у 2,5% культивируемых с микровезикулами клеток костного мозга. В то же время, если костный мозг заменялся на культуру миелоидных либо лимфоидных клеток, процент клеток с двойным окрашиванием составлял соответственно 27% и 0,7%.
Можно сделать вывод о разной степени восприимчивости тканей к такого рода «общению». Вероятно, определенную роль здесь играют лиганд-рецепторные взаимодействия между мембранами клеток и микровезикул. Далее авторы провели анализ экспрессии тканеспецифичных генов в окрашенных (проглотивших микровезикулы) и неокрашенных клетках, которые были отделены друг от друга с помощью проточного сортера (этот прибор не просто измеряет флуоресценцию, а еще и разбрасывает клетки с разным уровнем флуоресценции по разным пробиркам в соответствии с заданными критериями для разделения; в данном случае отделяли клетки, имеющие две флуоресцентных метки — красную и зеленую, — от всех прочих клеток). Оказалось, что экспрессия анализируемых мРНК в окрашенных клетках костного мозга была увеличена в десятки раз по сравнению с контрольными клетками и практически не изменилась в неокрашенных.
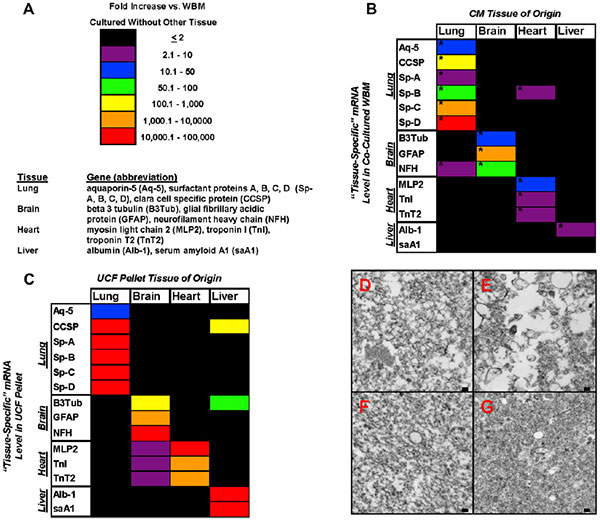
Пожалуй, самая интересная часть исследования заключается в оценке влияния культивирования клеток в присутствии микровезикул, полученных от разных тканей мыши, на спектр РНК-клеток костного мозга крысы, то есть другого вида животных. Оказалось, что сокультивирование клеток костного мозга крысы с микровезикулами, полученными от легочной либо печеночной ткани мыши после облучения приводили к повышению в клетках содержания как мРНК, типичных для данных тканей мышиных генов, так и мРНК крысиных гомологов этих генов. В качестве механизма такого влияния авторы предлагают рассматривать микроРНК, регулирующие активность этих генов. Действительно, такие микроРНК в большом количестве обнаруживались как в самих микровезикулах, так и в сокультивируемых с ними клетках костного мозга. В общей сложности в составе микровезикул, полученных от клеток легких, авторы обнаружили 185 различных микроРНК и 65 белков.
Всё это говорит о том, что поврежденные ткани, по-видимому, могут стимулировать в стволовых клетках костного мозга определенное направление дифференцировки, способное обеспечить регенерацию этих тканей и восстановление функционального состояния организма.
В то же время эти данные наталкивают на мысли о дарвиновских геммулах, нередко упоминаемых Александром Марковым, способных якобы переносить наследственные факторы от соматических клеток к генеративным. Марков указывает на возможность такого рода переноса генетического материала с помощью вирусных частиц, способных с некоторой частотой проникать в генеративные ткани. Хочется обратить внимание на то, что, по-видимому, организм и сам владеет достаточным набором инструментов для осуществления контролируемого переноса генетической информации от одних клеток к другим. Если учесть существование таких гибко управляемых систем многоклеточного организма, как 1) перенос между клетками микровезикул, содержащих РНК-копии различных генов (которые в соматических клетках могут приобретать какие-либо мутации), 2) обратная транскрипция и 3) рекомбинация генетического материала в генеративных клетках, то процесс «осознанного» переноса новых вариантов генов из соматических клеток в генеративные видится не таким уж невероятным событием, как это казалось прежде.
Банк должен быть уверен в том, что все риски учтены, поэтому полис КАСКО станет Вашим спутником на все время погашения кредита.


