|
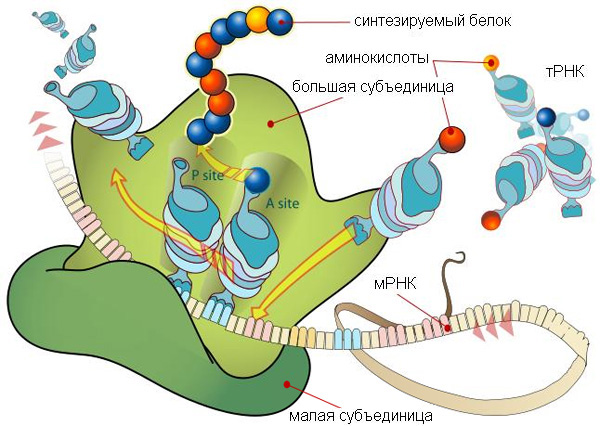
Рибосомы — сложные молекулярные комплексы, состоящие из рибосомных РНК (рРНК) и белков. Рибосомы играют ключевую роль в трансляции — синтезе белка по «инструкции», записанной при помощи генетического кода в молекуле матричной РНК (мРНК).
Рибосомы у всех живых существ — от бактерий до человека — устроены очень похоже. По-видимому, это означает, что рибосомы в их «современном» виде имелись уже у общего предка всех нынешних форм жизни (см. LUCA, Last universal common ancestor). Рибосома состоит из двух субъединиц — большой (главной) и малой (вспомогательной). Основу обеих субъединиц составляют молекулы рибосомной РНК (рРНК). Снаружи к молекулам рРНК прилегают молекулы рибосомных белков.
Согласно общепризнанной в настоящее время теории «РНК-мира», на ранних этапах развития жизни все основные функции, которые сегодня выполняются белками, выполнялись молекулами РНК. Появление системы синтеза белка на основе записанных в РНК «инструкций» стало ключевым событием, ознаменовавшим переход от «мира РНК» к привычному нам «белковому миру». Поскольку рибосомы являются центральным компонентом этой системы, вопрос о происхождении рибосом чрезвычайно важен для понимания того, как РНК-организмы превратились в первые прокариотические клетки.
До сих пор многим экспертам казалось, что загадка происхождения рибосом вряд ли когда-нибудь будет разгадана. Ведь в природе не осталось никаких «переходных звеньев», то есть более простых молекулярных комплексов, которые могли бы претендовать на роль «предков» рибосом. Однако канадские биохимики, похоже, нашли ключик к этой тайне в самой структуре рибосом современных организмов.
Они сосредоточились на самой главной части рибосомы — на молекуле 23S-рРНК, которая представляет собой основу большой субъединицы рибосомы кишечной палочки (Escherichia coli). Эта молекула весьма велика: она состоит почти из 3000 нуклеотидов. В клетке она сворачивается в сложный трехмерный «клубок». Разные петли, выступы и другие элементы структуры этого «клубка» обеспечивают выполнение разных функций: связь с рибосомными белками, присоединение малой субъединицы, присоединение и удерживание в нужных позициях молекул транспортных РНК (тРНК), которые несут на своих «хвостиках» (CCA-3'-концах) аминокислоты, необходимые для синтеза белка.
Ранее уже было показано, что рибосомные белки играют в рибосоме вспомогательную роль: они делают ее более стабильной и повышают эффективность ее работы, однако все главные действия, необходимые для синтеза белка, осуществляются не белками, а рибосомными РНК. Это значит, что изначально рибосомы могли состоять только из рРНК, а белки добавились позже. Самый главный этап трансляции — присоединение аминокислот к синтезируемой белковой молекуле (реакция транспептидации) — осуществляется молекулой 23S-рРНК. Поэтому логично предположить, что всё началось именно с этой молекулы.
|
Однако молекула 23S-рРНК слишком велика и сложна, чтобы появиться в готовом виде в результате случайного комбинирования нуклеотидов. Таким образом, ключевой вопрос состоит в том, могла ли 23S-рРНК произойти от более простой молекулы-предшественницы в результате постепенной эволюции, то есть путем последовательного добавления новых фрагментов. Главный вывод обсуждаемой статьи заключается в том, что структура 23S-рРНК свидетельствует именно о таком ее происхождении.
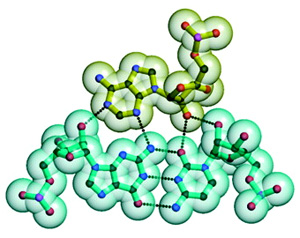
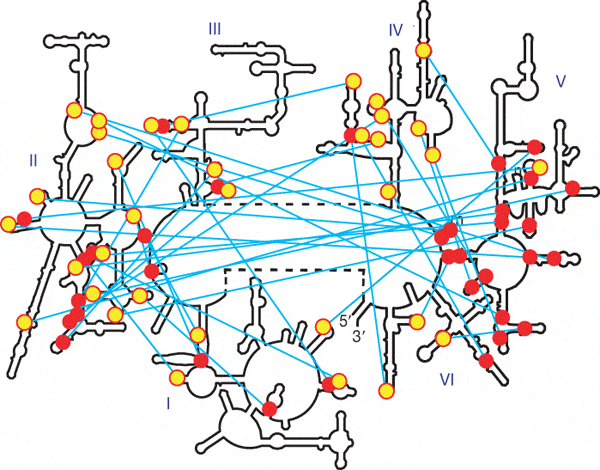
Молекула 23S-рРНК состоит из шести основных структурных блоков, или доменов. Каждый домен, в свою очередь, состоит из более мелких структурных единиц. Целостность трехмерной структуры молекулы поддерживается разнообразными связями (в основном водородными) между ее участками. Некоторые участки молекулы сворачиваются в двойные спирали на основе принципа комплементарности. Важную роль играют и так называемые «А-минорные» связи. А-минорная связь возникает между последовательностью из нескольких идущих подряд аденозинов (А) в одной части молекулы и двойной спиралью в другой ее части (см. рис. 2).
Исследуя структуру 23S-рРНК, авторы обратили внимание на следующее странное обстоятельство. Двойные спирали и образующие с ними А-минорные связи «стопки» аденозинов (adenosine stacks) распределены по шести доменам молекулы более или менее хаотично, за единственным исключением: в пятом домене наблюдается необычное скопление двойных спиралей и практически нет аденозиновых «стопок». Таким образом, А-минорные связи, образуемые пятым доменом, являются однонаправленными (см. рис. 3).
Это наблюдение навело авторов на мысль, что эволюция молекулы 23S-рРНК могла начаться с домена V или с какой-то его части. Дело в том, что А-минорные взаимодействия необходимы для поддержания стабильной трехмерной структуры той части молекулы, к которой принадлежит аденозиновая «стопка», но они не влияют на стабильность той ее части, к которой принадлежит двойная спираль. Иными словами, если мы разорвем какую-нибудь А-минорную связь, показанную на рис. 3 голубой линией, это нарушит структуру той части молекулы, где находится желтый кружок, но не причинит вреда той части, где расположен красный кружок. Таким образом, если 23S-рРНК развивалась постепенно из простой молекулы-предшественницы, то сначала должны были появляться двойные спирали (красные кружки), и только потом к ним могли «пристраиваться» аденозиновые стопки (желтые кружки).
|
Но если пятый домен был той «затравкой», с которой началась эволюция 23S-рРНК, то следует ожидать, что именно в этом домене находится какой-то важный функциональный центр молекулы. Так ли это? Оказывается, это действительно так: именно пятый домен играют ключевую роль в транспептидации. Он удерживает в правильных позициях CCA'-хвосты двух молекул тРНК (той, что принесла предыдущую аминокислоту, уже присоединенную к синтезируемому белку, и той, что принесла следующую аминокислоту, см. рис. 1). Именно пятый домен 23S-рРНК обеспечивает сближение новой аминокислоты с предыдущей, уже присоединенной к белку, и катализирует соединение аминокислоты с белком.
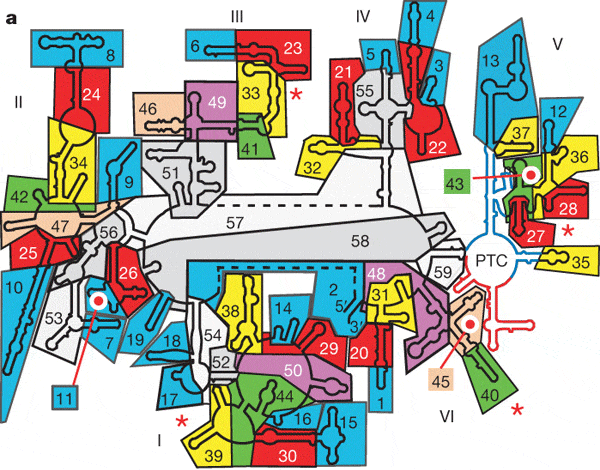
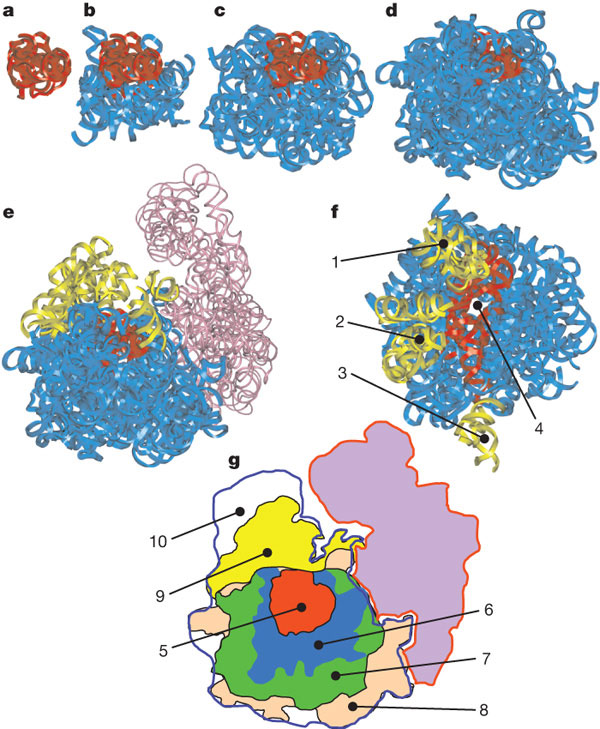
Обнаружив эти факты, исследователи перешли к более тонкому анализу структуры 23S-рРНК. Они подразделили молекулу на 60 относительно самостоятельных структурных блоков и детально проанализировали характер связей между ними. Фактически они рассматривали молекулу как сложный трехмерный «пазл» и пытались выяснить, поддается ли он сборке и разборке без поломки деталей. Оказалось, что молекулу действительно можно постепенно «разобрать», ни разу не нарушив структуру остающихся блоков. Сначала можно отделить 19 блоков, причем структура оставшихся блоков остается неповрежденной. После этого отделяются еще 11 блоков, затем еще 9, 5, 3, 3, 2, 2, 2; наконец, еще три блока можно отделить последовательно по одному. После этого остается «неразобранным» лишь маленький фрагмент молекулы, составляющий 7% от ее общей массы. Этот неразобранный фрагмент представляет собой участок пятого домена, содержащий в себе каталитический центр, ответственный за транспептидацию (пептидил-трансферазный центр, PTC, peptidyl-transferase centre).
|
Возможность последовательной разборки молекулы без повреждения остающихся частей — факт весьма нетривиальный. Все блоки молекулы связаны друг с другом, причем связи эти имеют направленный характер: при их разрыве один блок повреждается, а другой нет. Можно представить систему блоков и связей между ними как множество точек, соединенных стрелками, причем стрелка будет указывать на тот блок, который повреждается при разрыве связи. Если бы эти стрелки образовали хотя бы одну кольцевую структуру (иными словами, если бы мы, двигаясь из какой-то точки по стрелкам, могли вернуться в ту же точку), то разобрать молекулу без повреждения остающихся частей было бы невозможно. Однако ни одной такой кольцевой структуры в молекуле 23S-рРНК не обнаружилось. Если бы направление связей было случайным, вероятность отсутствия кольцевых структур составляла бы менее одной миллиардной. Авторы делают вывод, что это вряд ли результат случайности. По-видимому, структура связей между блоками молекулы отражает последовательность добавления этих блоков в ходе постепенной эволюции молекулы.
Получается, что исходной функциональной молекулой — «проторибосомой», с которой началась эволюция рибосомы, — был пептидил-трансферазный центр (PTC) пятого домена молекулы 23S-рРНК. Сам PTC состоит из двух симметричных лопастей. Каждая лопасть удерживает CCA'-хвостик одной молекулы тРНК. Логично предположить, что такая структура возникла в результате дупликации (удвоения) одной исходной лопасти.
Могла ли такая «проторибосома», способная удерживать две молекулы тРНК и сближать в пространстве прикрепленные к ним аминокислоты, выполнять какую-то полезную функцию в РНК-организме? Эксперименты позволяют ответить на этот вопрос утвердительно. Методом искусственной эволюции были получены функциональные РНК (рибозимы), способные катализировать транспептидацию (соединение аминокислот, прикрепленных к тРНК, в короткие белковые молекулы). Структура этих искусственно выведенных рибозимов очень близка к структуре той проторибосомы, которую «вычислили» авторы обсуждаемой статьи.
По-видимому, проторибосома была просто устроенным рибозимом, катализирующим синтез небольших белковых молекул в РНК-организме. Специфичность синтеза поначалу была очень низкой (аминокислоты выбирались более или менее случайно). В дальнейшем к проторибосоме добавлялись новые блоки, причем добавлялись они таким образом, чтобы не нарушить структуру активного центра молекулы, а также всех тех блоков, которые присоединились ранее. Если очередная мутация приводила к нарушению уже сложившихся структур, она отсеивалась отбором.
Авторы детально реконструировали предполагаемый процесс постепенной эволюции 23S-рРНК. Первые восемь дополнительных блоков присоединились к проторибосоме таким образом, что образовали нечто вроде массивного «основания», благодаря которому структура проторибосомы стала гораздо более стабильной. Следующие 12 блоков еще более укрепили и расширили это «основание». Новые блоки образовали поверхность контакта с малой субъединицей, что позволило включить ее в состав рибосомы. В числе последних добавились блоки, образующие особые выросты (protuberances) на поверхности большой субъединицы. Функция этих выростов состоит в том, что они помогают рибосоме выбирать «правильную» тРНК, несущую нужную аминокислоту, а также выпускать из рибосомы «отработанные» тРНК. В итоге проторибосома оказалась окружена другими блоками со всех сторон, за исключением канала, который был оставлен для выхода образующейся белковой цепочки.
Таким образом, 23S-рРНК, при всей ее кажущейся сложности, построена на основе довольно простого принципа. Ее блочная структура свидетельствует о том, что она могла довольно быстро развиться в ходе эволюции из проторибосомы под действием мутаций и отбора.
|
Авторы предполагают, что переход от РНК-мира к «белковому миру» состоялся после этапа, обозначенного буквой b на рис. 5. Дело в том, что те блоки рибосомы, которые показаны на рис. 5b, не контактируют с рибосомными белками. Они могли развиться еще до того, как у РНК-организма появилась возможность синтезировать белки с такой точностью, чтобы некоторые из этих белков могли пригодиться для укрепления и усовершенствования рибосом. Все остальные блоки рибосомы (начиная с рис. 5c) уже находятся в тесном контакте с рибосомными белками и «нуждаются» в них для поддержания своей стабильности. Вероятно, они добавлялись уже в «белковом мире», и их эволюция была изначально сопряжена с эволюцией белков.