Самыми важными для выявления альтернативного сплайсинга были, естественно, те 32-нуклеотидные фрагменты РНК, внутри которых оказалась точка сшивки экзонов. Именно по этим фрагментам можно понять, какие участки РНК были вырезаны во время сплайсинга.
Оказалось, что альтернативному сплайсингу подвергается примерно 94% человеческих генов — гораздо больше, чем предполагалось ранее (прежние оценки были в районе 75%). Иногда причиной альтернативного сплайсинга могут быть случайные сбои в работе механизмов, осуществляющих сплайсинг (ключевую роль в нём играют сложные РНК-белковые комплексы — сплайсосомы). В этом случае «альтернативный» вариант зрелой мРНК должен встречаться очень редко по сравнению с «нормальным» вариантом. Однако такое характерно лишь для малой части генов, подвергающихся альтернативному сплайсингу. Даже если отбросить все случаи, когда частота альтернативной изоформы не превышает 15% во всех изученных пробах, всё равно остается 86% генов (от общего числа генов в геноме), у которых альтернативный сплайсинг наверняка не случаен.
|
Таким образом, почти все человеческие гены кодируют не по одному, а по несколько разных белков. Этот факт сам по себе очень важен, поскольку он позволяет ответить на вопрос, который не давал покоя генетикам с тех самых пор, как был прочтен геном человека. В нашем геноме оказалось всего около 20 000 генов — примерно столько же, сколько у круглого червя Caenorhabditis elegans, который устроен гораздо проще, чем человек. Эксперты этого не ожидали: все были уверены, что в более сложном организме разнообразие белков должно быть выше, чем в простом. Теперь понятно, что так оно и есть, просто разнообразие белков у млекопитающих повысилось не за счет роста числа генов, а за счет развития альтернативного сплайсинга и роста числа изоформ. У C. elegans, по имеющимся оценкам, лишь около 15% генов подвергаются альтернативному сплайсингу.
Очень важно выяснить, насколько различаются белки-изоформы по своим функциям. В принципе можно допустить, что в большинстве случаев альтернативный сплайсинг не оказывает существенного влияния на свойства получающегося белка, и разные изоформы сосуществуют в организме просто потому, что организму безразлично, какая из изоформ будет синтезироваться в тех или иных тканях.
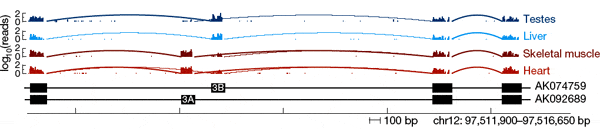
Напрямую определить функции и свойства каждой изоформы — задача на сегодняшний день неподъемная, так что приходится идти окольными путями. Одним из таких путей является анализ тканеспецифичности сплайсинга. Иными словами, нужно выяснить, как распределяются изоформы по органам и тканям — хаотично или упорядоченно. Если свойства альтернативных изоформ примерно одинаковы, то они, скорее всего, будут распределяться по тканям более или менее хаотично. Если же они различны, то организм не может пустить дело на самотек: обязательно должны были развиться системы регуляции альтернативного сплайсинга, которые направляли бы сплайсинг в ту или иную сторону в зависимости от ситуации, то есть от потребностей данного органа или ткани. В этом случае ткани должны резко различаться между собой по набору изоформ белков, подвергающихся альтернативному сплайсингу.
Результаты, полученные американскими исследователями, убедительно свидетельствуют в пользу второй версии. Оказалось, что у большинства генов альтернативный сплайсинг тканеспецифичен: в одних тканях чаще синтезируются одни изоформы, в других — другие. Интересно, что среди генов, сплайсинг которых отличается наиболее строгой тканеспецифичностью (в одних тканях всегда или почти всегда синтезируется только одна изоформа, в других — другая) повышена доля генов — регуляторов индивидуального развития, обмена веществ, межклеточных взаимодействий и передачи сигналов. Это именно те функции, от которых зависят структурные и функциональные различия между тканями. Это говорит о том, что альтернативный сплайсинг, по-видимому, в большинстве случаев имеет функциональное значение и идет под жестким контролем.
Была обнаружена также и индивидуальная вариабельность «рисунка» альтернативного сплайсинга: у разных людей в одних и тех же тканях может быть разное соотношение изоформ. Однако различия между индивидуумами в среднем примерно в 2-3 раза меньше, чем различия между тканями. В ряде случаев, по-видимому, альтернативный сплайсинг может зависеть и от аллельных вариантов. Многие гены в популяции существуют в виде нескольких вариантов (аллелей), и для разных аллелей может быть характерно разное распределение вероятностей производства тех или иных изоформ. Именно этим, скорее всего, и объясняется значительная часть обнаруженных индивидуальных различий (ведь у каждого человека имеется свой уникальный набор аллелей, за исключением однояйцовых близнецов).
Как осуществляется регуляция сплайсинга в разных тканях? По-видимому, ключевую роль в этом играют специализированные регуляторные белки и особые регуляторные последовательности нуклеотидов, расположенные в интронах, прилегающих к альтернативным экзонам. Ранее уже был выявлен ряд белков — регуляторов сплайсинга, а для некоторых из них была показана тканеспецифичная экспрессия. Например, белки — регуляторы сплайсинга FOX-1 и FOX-2 активно синтезируются в клетках мозга, сердца и скелетных мышц. Эти белки распознают участки матричных РНК с последовательностью нуклеотидов UGCAUG и прикрепляются к ним, что, в свою очередь, как-то влияет на работу сплайсосомы. Было также показано, что частота встречаемости этой нуклеотидной последовательности (UGCAUG) резко повышена в интронах, следующих непосредственно за альтернативными экзонами, которые преимущественно включаются в зрелую мРНК как раз в клетках мозга, сердца и мышц. Кроме того, последовательность UGCAUG часто встречается в интронах, предшествующих альтернативным экзонам, которые не используются в перечисленных тканях. Это значит, что если последовательность UGCAUG расположена перед экзоном, белки FOX «приказывают» сплайсосоме вырезать этот экзон, а если она расположена после экзона, белки FOX не позволяют его вырезать.
Эти факты были установлены три года назад. Опираясь на них, авторы предприняли целенаправленный поиск других регуляторных шестинуклеотидных последовательностей в интронах, прилегающих к альтернативным экзонам. Они нашли еще 362 такие последовательности, среди которых есть как известные ранее регуляторы (сайты связывания белков — регуляторов сплайсинга), так и новые. Например, перед альтернативными экзонами, используемыми в коре мозжечка, часто располагаются последовательности UCUCUC и CUCUCU, напоминающие известные ранее сайты связывания белков — регуляторов сплайсинга PTBP1 и PTBP2. По-видимому, реальное разнообразие белков — регуляторов сплайсинга и соответствующих регуляторных нуклеотидных последовательностей значительно выше того, что известно на сегодняшний день.
Для полноты картины остается добавить, что практически все человеческие гены, которые не подвергаются альтернативному сплайсингу (как мы помним, таковых оказалось 6%) — это гены, которые вообще никакому сплайсингу не подвергаются, потому что в них нет интронов. Это заставляет задуматься: а бывает ли вообще у млекопитающих безальтернативный сплайсинг? Несколько в ином свете предстает и роль интронов: их регуляторные функции были известны и раньше, но теперь стало совсем уж очевидно, что интроны тоже, как и экзоны, кодируют инструкции по синтезу белка. Хотя, конечно, до тех пор, пока аналогичные исследования не будут проведены на других видах живых организмов, далеко идущие эволюционные выводы делать рано.