|
Американские ученые разработали новый метод получения стволовых клеток, который предполагает преобразование соматической клетки в стволовую с помощью аденовирусов. Специально подготовленные аденовирусы привносят в соматическую клетку необходимый набор эмбриональных генов, которые и запускают процесс омоложения клетки. В отличие от прежних, новая технология не изменяет геном исходной клетки и не вызывает появления опухолей.
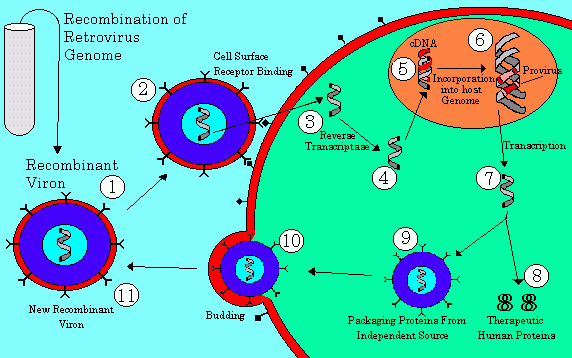
В области исследования стволовых клеток серьезные усилия ученых направлены на поиск действенных технологий перепрограммирования соматических клеток в плюрипотентные, то есть способные к различной специализации. В течение последних двух-трех лет были определены гены, которые работают в стволовых клетках и определяют экспрессию генома на самых ранних стадиях развития эмбриона. Это гены транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog и некоторые другие. Если ввести их в соматическую клетку, например в фибробласт, то клетка перерождается и приобретает свойства плюрипотентности. Каким образом можно доставить эти гены в клетку, и не просто доставить, а еще и заставить их там работать?Сейчас эксплуатируется вирусная и липосомная передача генов. Липосомы с заключенными внутри генами «плюрипотентности» внедряются в клетку, но эффективность встраивания и активации трансгенного материала чрезвычайно низка. Более эффективно использование вирусного носителя или вирусного вектора (см. схему).
|
Обезвреженные РНК-вирусы (ретровирусы), содержащие требуемые гены вместе с генами ревертазы и некоторыми другими (на схеме — 1), направляются к клетке. После того как клетка с помощью рецепторов опознает вирусную оболочку (2), вирус внедряет в клетку РНК (3). В клетке РНК с помощью ревертазы (обратной транскриптазы) переписывается в ДНК (4) и проникает в ядро соматической клетки (5). Там синтезированная чужеродная ДНК, несущая нужные гены и некоторые вирусные гены, встраивается в ДНК самой клетки (6). После чего всё идет своим чередом: клетка при делении синтезирует копии обновленного генома, синтезирует мРНК (7), необходимые терапевтические белки (8), ради которых и была затеяна эта сложная процедура. РНК вируса одеваются вирусной оболочкой и выходят из клетки, заражая новые поколения клеток (10).
Если встраивание чужеродной ДНК произошло в безопасном месте, то соматическая клетка «молодеет», перерождается в стволовую, или, точнее, происходит процесс индукции плюрипотентных клеток. Однако зачастую гены внесенных транскрипционных факторов встраиваются неудачно, и тогда соматическая клетка превращается в опухолевую. Кроме того, эта технология в принципе подходит только для активно делящихся клеток. Для внедрения генного материала в неделящуюся клетку применяют аденовирусный вектор.
Аденовирусный вектор — это вирион с двухцепочечной ДНК, хорошо знакомый нам по назойливым простудным заболеваниям. Аденовирусы не способны встраиваться в геном клетки-хозяина, поэтому экспрессия внедренных генов только временная. Последнее свойство со всей очевидностью ограничивает использование аденовирусных векторов для терапевтических целей, так как достигается только временный лечебный эффект, но для ограниченного во времени процесса преобразования соматической клетки в стволовую этот метод подходит как нельзя лучше. Здесь важно только запустить процесс индукции.
Несмотря на известную теоретическую допустимость данной технологии, ее практическое осуществление документировано только сейчас. Эту технологию отработала группа специалистов из нескольких медицинских исследовательских центров штата Массачусетс (США) под руководством Конрада Хохедлингера (Konrad Hochedlinger) из Гарвардского института стволовых клеток. Попытки были предприняты и раньше, но они не увенчались успехом. Неудача объяснялась, по-видимому, быстрым растворением аденовирусов в соматических клетках.
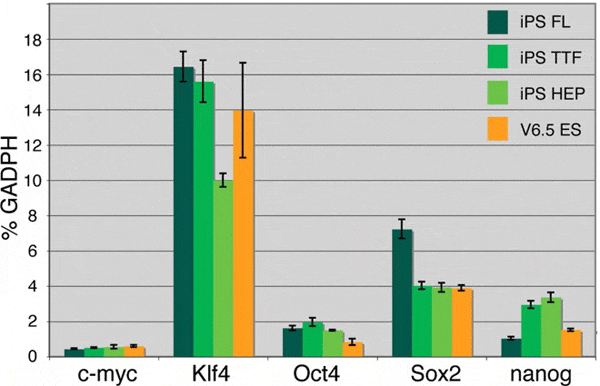
На этот раз исследователи применили новую методику, разработанную группой в последнее время. В ней используется линия мышей с геном Oct4, транскрипция которого активируется антибиотиком доксициклином. Поэтому в первой серии экспериментов ученые ставили опыты с клетками именно этой линии мышей. В качестве «подопытных» соматических клеток были выбраны мышиные эмбриональные клетки печени, фибробласты и взрослые гепатоциты; клетки обрабатывались доксициклином параллельно с вирусным заражением. В результате начиналась экспрессия гена Oct4, которая запускала целый каскад реакций. Опыт продолжался около месяца. За это время все типы клеток показали способность к перепрограммированию, дав по нескольку колоний индуцированных плюрипотентных клеток. В этих колониях синтезировались свои собственные, уже не вирусные эмбриональные гены.
|
Важно было показать, что аденовирусное перерождение клеток возможно и в линиях нормальных мышей, без доксициклин-зависимого аллеля Oct4. Такой эксперимент был поставлен на клетках взрослых гепатоцитов. Эти клетки больше других подвержены заражению аденовирусом. Через месяц инкубации были выделены колонии клеток, в которых нормально работали требуемые эмбриональные гены. Превращение взрослых гепатоцитов в стволовые клетки происходило за счет деметилирования необходимых эмбриональных генов. У зрелых соматических клеток эмбриональные гены, напротив, гиперметилированы и поэтому не работают.
Ученые отмечают очень низкую эффективность аденовирусного перепрограммирования клеток: при ретровирусном переносе 0,01–0,1%, а при аденовирусном — 0,0001–0,001%. Зато у этого метода есть несколько важнейших преимуществ. Первое из них — ни в одном случае не появилось опухолевых образований, а при ретровирусном переносе клетки очень часто порождают опухоли. Второе — геном получившейся плюрипотентной клетки не имеет вирусных вставок и потому идентичен геному эмбриональной клетки; это делает возможным полное сравнение работы обоих геномов. Оба преимущества предполагают широкие возможности для будущих терапевтических разработок. Поэтому в последних строках своего сообщения авторы выразили надежду, что данная работа продолжится, но с использованием человеческих соматических клеток.