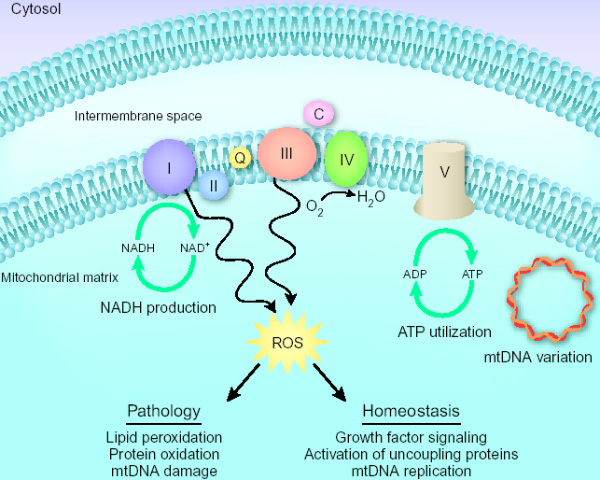
Активные формы кислорода (АФК), такие как супероксид-анион, считаются очень вредными, поскольку они повреждают белки, липиды и ДНК, приводя к старению клеток. АФК образуются как побочный продукт клеточного дыхания, которое происходит в митохондриях. Однако недавно ученые из Испании обнаружили, что АФК внутри клетки выполняют важную компенсаторную сигнальную функцию: они активируют синтез митохондриальной ДНК и регулируют таким образом дыхательную активность клетки.
|
Однако клеточные культуры, несущие различные мутации в митохондриальной ДНК (мтДНК), не проявляют отклонений и характеризуются примерно одинаковым со здоровыми культурами уровнем клеточного дыхания и роста, что ставит под сомнение связь этих мутаций с болезнями на уровне целого организма.
Чтобы разрешить этот парадокс, испанские биохимики из Сарагосы и Мадрида, авторы недавней статьи в журнале Nature genetics, изучили активность дыхания клеточных линий, обладающих одним и тем же ядерным геномом, но различающихся митохондриальными геномами. Эти клеточные линии были получены путем образования клеточных гибридов — слиянием безъядерной клетки (но с митохондриями) с безмитохондриальной (но с ядром).
Всего из клеток мышей было сконструировано пять линий: три с нормальной мтДНК — от мышей, которые не имеют каких-либо фенотипических отклонений (1, 2, 3 — здоровые), и две линии с мутантной мтДНК — от мышей, которые характеризуются ослаблением слуха с возрастом или низкой способностью к обучению (4, 5 — больные). Различия между линиями заключались лишь в нескольких мутациях в мтДНК, одна из которых была характерна именно для больных линий.
Испанские ученые измерили уровень клеточного дыхания здоровых и больных клеток. Выяснилось, что в отсутствие глюкозы, на питательной среде с галактозой, уровень клеточного дыхания у клеток больных линий был ниже, и они росли медленнее, чем здоровые. На глюкозной питательной среде, где у больных клеток была возможность компенсировать недостаток АТФ за счет гликолиза, различий в скорости роста не наблюдалось.
При этом оказалось, что в больных клетках повышена концентрация активных форм кислорода и их важного источника — перекиси водорода (Н2О2). На этом особенности больных линий 4 и 5 не закончились — выяснилось, что количество митохондриальной ДНК у них также заметно (на 60–90%) выше.
Итак, больные линии (I) хуже растут на галактозной среде (то есть у них понижена дыхательная активность), (II) имеют большую концентрацию активных форм кислорода и (III) имеют больше митохондриальной ДНК на клетку. Авторы предположили, что дыхательная способность на одну молекулу мтДНК в больных клетках ниже, чем в здоровых, однако повышенная концентрация АФК индуцирует репликацию мтДНК, что увеличивает в больных клетках количество молекул мтДНК и отчасти компенсирует проблемы с клеточным дыханием, позволяя поддерживать его на относительно нормальном уровне.
Чтобы проверить эту гипотезу, ученые добавили в питательную среду антиоксиданты, нейтрализующие Н2О2 и супероксид-анион. Однонедельная инкубация с антиоксидантами на среде с глюкозой не повлияла на уровень потребления кислорода линиями 1, 2 и 3, а вот дыхательная способность и количество митохондриальной ДНК у линий 4 и 5 значительно снизились. Видимо, антиоксиданты элиминировали в больных линиях избыток АФК, что повлекло за собой снижение числа копий мтДНК и дыхательной способности всей клетки.
Когда эксперимент был повторен на галактозной среде, антиоксиданты привели к снижению роста всех линий — и больных, и здоровых, из чего авторы сделали вывод, что АФК могут участвовать в переключении метаболизма с глюкозного на галактозный.
И действительно, оказалось, что в ответ на смену глюкозной среды на галактозную в клетках линий 1, 2 и 3 наблюдался взрыв в выработке АФК — что в свою очередь приводило к увеличению количества митохондриальной ДНК и, соответственно, к повышению уровня клеточного дыхания. Таким образом, здоровым клеткам удавалось быстро компенсировать недостаток АТФ, возникавший из-за прекращения гликолиза. В клетках линий 4 и 5 выработка АФК оставалась на прежнем уровне — по-видимому, из-за того, что в них и так уже наблюдался избыток активных форм кислорода.
Таким образом, АФК играют ключевую роль в одном из ранее неизвестных внутриклеточных компенсаторных механизмов. Когда выработка АТФ в клетке становится недостаточной (в силу мутации или из-за перехода от глюкозного питания к галактозному), увеличивается выработка активных форм кислорода, которые в свою очередь стимулируют увеличение числа копий мтДНК и, как следствие, число ферментов дыхательной цепи.
Так что наряду с вредными функциями АФК (повреждение белков, липидов и ДНК) новые исследования всё больше обнаруживают и их полезные функции — такие как активация разобщающих белков (uncoupling proteins), регулирующая продукцию АТФ, и передача сигналов роста через тирозин-киназы. Теперь обнаружена еще одна роль АФК — компенсаторная регуляция активности клеточной дыхательной цепи через активацию репликации митохондриальной ДНК.
Правда, остается открытым вопрос о том, можно ли данную модель функциональной регуляции митохондрий с участием АФК приложить и к различным вариантам мтДНК человека. Если эта модель будет экспериментально подтверждена для человека, то лечение митохондриальных нейродегенеративных болезней с помощью антиоксидантов (см. У болезни Паркинсона и старения общие причины, «Элементы», 14.06.2006), может оказаться бесполезным или даже вредным, поскольку будет нивелировать адаптивную компенсаторную роль АФК.