|
Выбор брачного партнера — одна из самых ответственных задач в жизни любого организма, способного к такому выбору. «Элементы» неоднократно рассказывали о разнообразных принципах и механизмах выбора партнера, сложившихся в ходе эволюции у животных, в том числе у насекомых (см. ссылки внизу). Несмотря на большие усилия, прилагаемые учеными, многое в этих механизмах остается неясным. Системы коммуникации, позволяющие животным выбирать оптимальных партнеров, бывают весьма сложными. Они могут включать много разных типов сигналов: звуковые (песни), зрительные (брачная окраска), поведенческие (специальные позы, танцы), хеморецепторные (различные запахи, феромоны, а также специфические молекулы, несущие персональную информацию). При этом смысл каждого сигнала может зависеть от контекста, то есть от других сигналов, что крайне затрудняет их расшифровку.
В химической коммуникации насекомых важную роль играют углеводородные феромоны. Муха Drosophila melanogaster — излюбленный объект генетиков — производит десятки разных углеводородов, различающихся длиной углеродной цепи, ее разветвленностью, числом и положением двойных связей. Все они, по-видимому, участвуют в химическом общении мух, однако о значении конкретных молекул пока известно очень немногое.
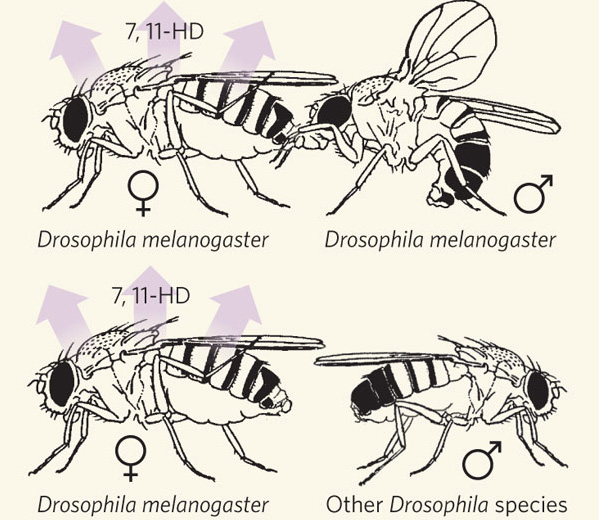
Было замечено, что некоторые углеводороды производятся преимущественно самками, другие — самцами. «Мужской» углеводород 7-T (Z-7-трикозен) привлекает самок, но отпугивает самцов. «Женские» углеводороды 7,11-HD (7Z,11Z-гептакозадиен) и 7,11-ND (7Z,11Z-нонакозадиен), по-видимому, привлекают самцов. Генетически модифицированные самцы, выделяющие эти женские феромоны, воспринимаются нормальными самцами как самки и подвергаются сексуальным домогательствам. Кроме того, было установлено, что самцы во время спаривания передают самкам порцию феромона cVA (cis-vaccenyl acetate), который отпугивает других самцов и повышает вероятность того, что данная самка сохранит верность своему первому партнеру.
В последнем номере журнала Nature американские биологи сообщили о новых важных результатах, которые им удалось получить благодаря успехам генной инженерии. Одна из главных трудностей в изучении химического языка насекомых состоит в том, что экспериментатору крайне трудно манипулировать составом углеводородов, находящихся на поверхности кутикулы. Можно, конечно, удалить феромоны с кутикулы дрозофилы, прополоскав ее в бензине или спирте, — но такую муху уже нельзя будет использовать в поведенческих опытах.
Чтобы создать мух, не способных производить углеводородные феромоны, авторы вставили в геном дрозофилы особую генетическую конструкцию, которая должна была уничтожить эноциты — специализированные клетки, располагающиеся под кутикулой брюшка у насекомых. Считалось (хотя и не было строго доказано), что именно эноциты отвечают за синтез углеводородных феромонов. Эноциты — модельный объект, используемый, в частности, для изучения генетической регуляции индивидуального развития (см.: Gould et al., 2001. Insect oenocytes: a model system for studying cell-fate specification by Hox genes). Поэтому уже известны промоторы (регуляторные участки генов), активизирующиеся только в эноцитах и нигде более. Чтобы получить мух без эноцитов, авторы вставили в геном дрозофилы ген Wrinkled, активизация которого заставляет клетку совершить самоубийство (см. апоптоз), объединенный с «эноцитовым» промотором. В результате в ходе развития насекомого клетки, превратившиеся в эноциты, вскоре погибают.
Эта стратегия не сразу привела ученых к успеху. Сначала все генетически модифицированные насекомые погибали на стадии личинки. По-видимому, личинки дрозофил не могут жить без эноцитов. Генетическую конструкцию пришлось усложнить, чтобы ген апоптоза включался только у взрослых мух, а у личинок оставался неактивным. Только после этого ученым удалось наконец получить живых взрослых дрозофил, лишенных эноцитов (oe–).
И самцы, и самки oe– оказались почти начисто лишены углеводородных феромонов. Тем самым была подтверждена гипотеза о том, что именно эноциты отвечают за их производство. Исключение составил мужской феромон cVA, который производится не эноцитами, а клетками половой системы.
Мух oe– можно было теперь использовать в качестве «чистого листа» для изучения роли отдельных углеводородов.
Результаты оказались весьма неожиданными. Выяснилось, что отсутствие углеводородных феромонов не приводит к видимым изменениям брачного поведения (ухаживания). Самцы oe– совершенно нормально ухаживали за самками дикого типа, лишь немного уступая в напористости «диким» самцам. Правда, особым успехом у самок они не пользовались: в среднем у самца oe– уходило вчетверо больше времени на соблазнение самки, чем у дикого самца. Таким образом, отсутствие феромонов у самца почти не влияет на его собственное поведение, но снижает его привлекательность для самок.
Став малоинтересными для самок, «дезодорированные» самцы oe– при этом стали весьма привлекательными для самцов (как диких, так и других oe– ). Судя по всему, самцы oe– воспринимаются другими самцами как самки. Взаимные ухаживания самцов oe– приводят к причудливым трансформациям полового поведения. Например, два самца могут долго кружиться, уткнувшись друг в друга головами. Нетрадиционное половое поведение безэноцитных самцов запечатлено в двух фильмах, прилагающихся к статье.
Самец oe– перестает быть объектом гомосексуальных домогательств, если обработать его мужским феромоном 7-T. Это подтверждает предполагавшуюся ранее роль 7-Т в предотвращении гомосексуальных взаимодействий у самцов дрозофил.
Дезодорированные самки oe– с точки зрения диких самцов стали совершенно неотразимыми («сексуальными гиперстимулами»). При наличии выбора самцы предпочитали спариваться с такими самками, а не с обычными, выделяющими разнообразные углеводороды. Это значит, что женские углеводородные феромоны служат не для привлечения самцов, а скорее наоборот — для их сдерживания. Возможно, это позволяет самке в более спокойной обстановке разобраться, подходит ли ей этот ухажер.
Исходя из полученных результатов авторы предположили, что феромоны могут содержать информацию о половой и видовой принадлежности, а их влияние на сексуальную привлекательность может быть разным в зависимости от контекста.
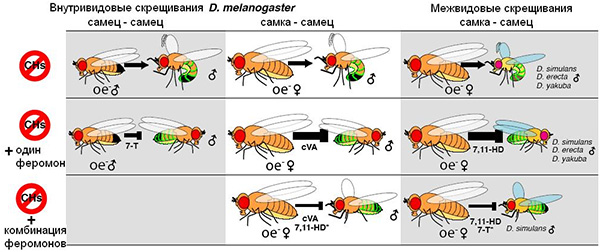
Чтобы проверить эти предположения, авторы обрабатывали «дезодорированных» мух oe– женским феромоном 7,11-HD (который до сих пор считался «женским афродизиаком», то есть средством привлечения самцов) и мужским феромоном cVA, при помощи которого самцы отпугивают от своей партнерши других ухажеров. Ранее было показано, что феромон cVA действительно снижает привлекательность самок, однако действие его не абсолютно: многие самки в природе всё-таки откладывают яйца, оплодотворенные несколькими разными самцами.
Оказалось, что сам по себе женский феромон 7,11-HD не влияет на привлекательность самок oe–. Однако он существенно уменьшает отпугивающий эффект феромона cVA. Самки oe–, обработанные феромоном cVA, не вызывали интереса у самцов. Однако если самку oe– обработать одновременно обоими феромонами — 7,11-HD и cVA — то она становится такой же привлекательной для самцов, как и дикие самки.
По-видимому, сексуальная привлекательность самки определяется сочетанием сигналов-репеллентов, при помощи которых самец пытается отвратить от нее других самцов, и сигналов, выделяемых самкой, которые подавляют действие репеллентов. В этом проявляется конфликт интересов самцов и самок: первые заинтересованы в верности своих партнерш, а вторые — совсем наоборот (самкам выгодно иметь более широкий выбор спермы, то есть генов для своего потомства, поэтому они предпочитают спариться с несколькими самцами; см.: sexual conflict).
Авторам удалось также продемонстрировать роль углеводородных феромонов в формировании межвидовой репродуктивной изоляции. Для этого они скрещивали D. melanogaster (диких и oe–) с мухами из трех близких видов: D. simulans, D. yakuba и D. erecta. Из этих трех видов у двух первых вообще нет специфических женских углеводородных феромонов, а у третьего вида они есть, но не такие, как у D. melanogaster.
|
Самцы всех трех видов либо вовсе не хотели ухаживать за дикими самками D. melanogaster, либо делали это очень неохотно. Однако они с большим энтузиазмом ухаживали за самками oe–. Следовательно, углеводородные феромоны, выделяемые самками D. melanogaster, участвуют в поддержании репродуктивной изоляции между видами: они отпугивают «чужих» самцов. Ранее высказывалось предположение, что эту функцию может выполнять уже знакомый нам женский феромон 7,11-HD. Эксперименты подтвердили эту гипотезу. Оказалось, что если самку oe– обработать этим феромоном, она перестает привлекать самцов чужих видов. Более того, если тем же феромоном обработать самку D. simulans, D. yakuba или D. erecta, она становится непривлекательной даже для своих родных самцов. Зато самка любого из четырех видов, обработанная этим феромоном, становится желанным партнером для самцов D. melanogaster. Попутно выяснилось, что самцы D. melanogaster проявляют интерес к самкам D. erecta даже без предварительной обработки феромоном 7,11-HD. Возможно, это объясняется тем, что самки D. erecta, как и самки D. melanogaster, производят другой специфический женский феромон — 7,11-ND.
Таким образом, феромон 7,11-HD несет двойную смысловую нагрузку: он информирует самцов не только о половой, но и о видовой принадлежности самок D. melanogaster.
Авторы отмечают, что у разных видов дрозофил одни и те же углеводородные феромоны могут выполнять разные функции, то есть иметь разный смысл. Например, феромон T-7 у D. melanogaster вырабатывается преимущественно самцами, привлекает самок и отпугивает других самцов. У D. simulans этот феромон вырабатывается в большей степени самками и не отталкивает, а привлекает самцов. Оказалось, что если намазать самку oe– феромоном T-7, это делает ее лишь немного более привлекательной для самцов D. simulans. Если такую же самку намазать феромоном 7,11-HD, то это, как мы помним, делает ее неинтересной для самцов всех видов, кроме «своего». Однако феромон T-7, как выяснилось, обладает способностью резко уменьшать отталкивающее действие феромона 7,11-HD на самцов D. simulans. Иными словами, эффективность феромона T-7 зависит от того, была ли самка oe– предварительно обработана феромоном 7,11-HD: если да, то феромон Т-7 резко повысит ее привлекательность для самцов D. simulans, если нет — эффект будет гораздо слабее. Из этого видно, что возможность сложных взаимодействий между феромонными сигналами характерна не только для D. melanogaster. Вероятно, эта возможность заложена в общей архитектуре системы коммуникации при помощи углеводородных феромонов и соответствующих рецепторов, о которых мы пока еще знаем очень мало.
По-видимому, логика феромонной коммуникации у дрозофил основана на том, что все мухи исходно являются сексуально привлекательными друг для друга (по крайней мере для самцов), и на эту общую исходную привлекательность феромоны накладывают «дополнительную» информацию о половой и видовой принадлежности. При этом смысл отдельных сигналов может зависеть от контекста, включающего множество других сигналов: химических, зрительных, звуковых и прочих. Ученые пока сделали лишь самые первые шаги к расшифровке этого необычайно сложного языка.
Авторы допускают, что спектры кутикулярных углеводородов могут использоваться также и для индивидуального узнавания, то есть могут немного различаться у разных особей, и другие мухи способны уловить эти различия. Напомним, что у позвоночных, в отличие от насекомых, наличие уникального персонального запаха — надежно установленный факт.