Работа, проведенная Джэйсоном Джествики из Университета Мичигана, специалиста в области мультибелковых комплексов, с сотрудниками, может пролить свет на механизм работы Hsp70 на молекулярном уровне. Новое понимание о Hsp70 является важным, потому что этот белок играет роль при развитии рака, инфекионых заболеваний и нейродегенеративных заболеваний. В работе также представлен план для получения контрастных биологических эффектов на основе небольших химических структур.
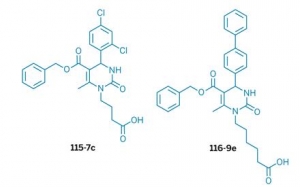
Два года назад, группа Джествики в сотрудничестве с двумя группами из Университета Питтсбурга возглавляемыми Джефри Бродски и Питером Уипфом, идентифицировали две маленькие молекулы, которые влияют на Hsp70. Одна молекула, называемая 115-7c, активирует шаперон, и соответствующее соединение, 116-9e, ингибирует его как in vitro так и in vivo. Исследователи были удивлены, что две схожие маленькие молекулы могут иметь столь противоположные эффекты на одну и ту же систему.
Джествики с сотрудниками использовали ПМР, мутагенез и другие методы для понимания того, как это происходит. Удивительно, но изучение показало, что 115-7c и 116-9e связываются с одной и той же поверхностью белок-белок, образованной при связывании Hsp70 белком Hsp40, который регулирует активность белка Hsp70.
Соединение 115-7c связывается с поверхностью Hsp40-Hsp70 и возникает эффект кооперации с Hsp40 для активации Hsp70. Другой агент, 116-9e, не активирует Hsp40. Вместо этого он блокирует связывание Hsp40-Hsp70.
Обнаружение лекарство-подобных агентов с любым влиянием на поверхности белок-белок, которые, как правило, очень велики, чтобы подвергаться действию малых молекул является очень необычным. Кроме того, наличие противоположных эффектов для сходных по химическому строению агентов, по мнению ученых, делает это исследование вдвойне удивительным. Пока неизвестно других подобных примеров, в которых одна небольшие молекулы сходного строения, такие как 115-7c и 116-9e влияли на поверхность белок-белок в противоположных направлениях.