Эксперименты показали, что главные производители карбоната кальция в мировом океане — микроскопические водоросли кокколитофориды — реагируют на рост концентрации CO2 в атмосфере не снижением, как ожидалось, а значительным увеличением продукции. Эти экспериментальные данные подтверждаются результатами послойного изучения кокколитофорид в донных морских отложениях, показавшими, что за последние 220 лет скелеты кокколитофорид стали массивнее в среднем на 40%.
|
Кокколитофориды — обширная группа мелких одноклеточных планктонных водорослей, образующих на поверхности клетки ажурные известковые пластинки — кокколиты. Кокколиты прекрасно сохраняются в ископаемом состоянии и широко используются в стратиграфии (для корреляции отложений и установления относительного возраста осадочных пород).
Начиная с середины мезозойской эры кокколитофориды были и остаются главными производителями карбоната кальция в мировом океане. Из известковых скелетиков кокколитофорид в основном состоит и всем известный писчий мел, и современные донные отложения во многих районах океана.
|
Считается, что рост концентрации CO2 в атмосфере в целом должен оказывать угнетающее воздействие на морские организмы с известковым (кальцитовым) скелетом, такие как кораллы, фораминиферы и кокколитофориды. Растворяясь в воде, углекислый газ превращается в угольную кислоту (H2CO3), что повышает кислотность воды. В принципе, это должно повышать растворимость кальцита и негативно сказываться на организмах с кальцитовым скелетом. Однако в действительности всё гораздо сложнее, особенно когда речь идет об организмах, которые, подобно кокколитофоридам, не только образуют кальцитовый скелет, но еще и фотосинтезируют.
Угольная кислота, реагируя с ионами карбоната (CO32–) и молекулами воды, образует ионы гидрокарбоната (HCO3–). Снижение концентрации CO32– снижает величину насыщенности океана кальцитом (?-cal); если ?-cal опускается ниже единицы, кальцит растворяется. С другой стороны, тот же самый процесс ведет к росту концентрации ионов гидрокарбоната, которые служат «строительным материалом» для построения кальцитового скелета кокколитофоридами:
Ca2+ + 2HCO3– > CaCO3 + CO2 + H2O
Изъятие из воды CaCO3, идущего на построение скелета, ведет к снижению pH и стимулирует — через короткую цепочку причинно-следственных связей — обратный выход CO2 из океана в атмосферу. Добавим к этому фотосинтез, в ходе которого CO2 активно изымается из воды и включается в состав органических веществ. Не забудем и о том, что после смерти кокколитофориды тонут, причем массивный кальцитовый скелет может играть роль груза, и поэтому от его массы может зависеть скорость изъятия органического и неорганического углерода из верхних слоев воды. В итоге получается весьма запутанная система связей и взаимодействий, которую не так-то просто моделировать и прогнозировать. Особенно если учесть, что интенсивность как фотосинтеза, так и кальцификации (образования известковых скелетов) у разных организмов зависит не только от абиотических условий (pH, ?-cal, концентрации CO2, CO32–, HCO3–, температуры, освещенности и т. д.), но и от генетических и физиологических особенностей.
Поэтому у науки до сих пор нет однозначных ответов на ряд весьма актуальных вопросов. Прежде всего хотелось бы знать, как реагируют — и как будут реагировать в будущем — морские организмы с известковым скелетом на продолжающийся рост концентрации CO2, и каким образом эта их реакция скажется на составе атмосферы и климате. Чтобы это понять, нужно прежде всего выяснить, как зависят процессы кальцификации и фотосинтеза от концентрации CO2 у наиболее массовых представителей фитопланктона, в первую очередь у кокколитофорид.
Большинство специалистов склонны считать, что рост концентрации CO2 должен снижать интенсивность кальцификации у морских организмов, в том числе у кокколитофорид. В ряде экспериментов на живых культурах кокколитофорид это предположение вроде бы подтвердилось. Однако группа океанологов и гидробиологов из Великобритании, Франции и США обратила внимание на то, что большинство таких экспериментов были проведены не совсем корректно: уровень pH в них регулировался путем добавления в воду небольших количеств кислоты или щелочи. Более реалистичную модель тех процессов, которые происходят в океане в наши дни и будут происходить в будущем в связи с ростом концентрации CO2, можно получить, пропуская через воду пузырьки углекислого газа.
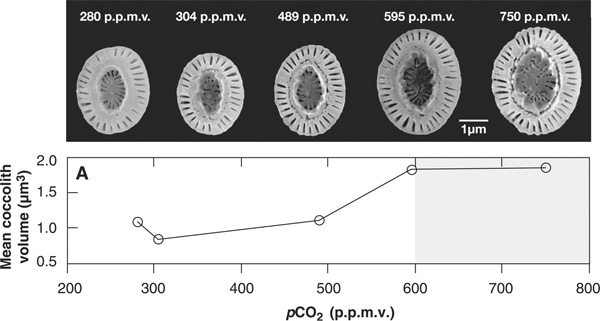
Именно так и поступили исследователи. Они изучили рост клеток самого массового вида кокколитофорид Emiliania huxleyi при различных концентрациях растворенного CO2 — от существовавших до начала промышленной революции до тех, которые ожидаются к концу нынешнего века (примерно втрое более высоких).
Оказалось, что по мере роста концентрации CO2 кокколитофориды уверенно наращивают как производство биомассы (измерялось количество углерода, включенного в состав органического вещества клеток), так и кальцификацию (измерялось количество углерода, включенного в состав скелетов). Скорость роста клеток несколько снизилась, однако сами клетки стали крупнее, а скелеты массивнее.
|
Важно, что интенсивность кальцификации и фотосинтеза (то есть скорость включения углерода в состав скелета и живой массы) росли параллельно, так что их соотношение практически не изменилось.
Если эксперимент был поставлен правильно и результаты достоверны, то в течение последних двух столетий средний размер кокколитов в океане должен был существенно увеличиться.
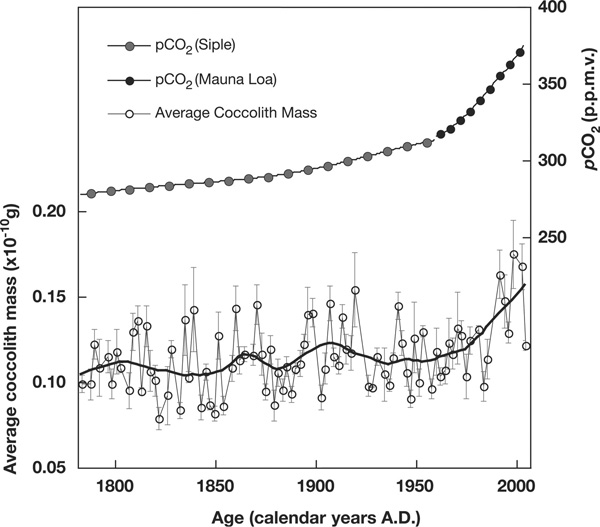
Чтобы проверить это, авторы изучили донные отложения из Северной Атлантики. Пробы были взяты в точке с координатами 57°27' с. ш., 27°55' з.д. на глубине 2630 м. В этом районе осадки накапливаются с необычно высокой для открытого океана скоростью — 2,3 мм в год, что позволило весьма детально проанализировать динамику размеров кокколитов за период с 1780-го по 2004 год.
Предположения авторов полностью подтвердились. Средняя масса кокколита увеличилась — от 1,08 ? 10–11 г в 1780 году до 1,55 ? 10–11 г в 2004 году. Особенно быстрый рост начался в 1960-е годы, что хорошо согласуется с данными по динамике концентрации CO2.
|
В отложениях представлены не только кокколиты Emiliania huxleyi, но и более десятка других видов кокколитофорид, причем количественное соотношение разных видов практически не менялось со временем. Авторам удалось измерить в каждой послойной пробе только среднюю массу всех кокколитов в целом (а не каждого вида по отдельности), поэтому они не смогли определить относительный вклад каждого вида в общее увеличение размеров кокколитов. Однако кокколиты Emiliania huxleyi составляют в среднем лишь 3% общей массы кокколитов в этих пробах, поэтому ясно, что с ростом концентрации CO2скелет становится массивнее не только у этого вида, но и у других.
Таким образом, можно заключить, что рост концентрации углекислого газа не угнетает, а, наоборот, стимулирует образование кальцитовых скелетов по крайней мере у некоторых видов кокколитофорид в некоторых районах океана. Этот факт, несомненно, необходимо учитывать в геохимических моделях, однако многое по-прежнему остается неясным. В частности, необходимо выяснить, как влияет рост CO2 на других кокколитофорид в других районах океана, как отражается увеличение массивности скелета на скорости изъятия органического углерода из верхних слоев воды, и многое другое.