
КАК ЗАРОДИЛАСЬ ЖИЗНЬ?
Резюме:
Построена новая теория зарождения жизни на Земле, согласно которой переход от разнородных органических молекул к первым живым организмам включал четыре взаимосвязанных эволюционных шага. На первом шаге формировались молекулярные системы, преобразующие энергию Уф-излучения в хим энергию, на втором и 3-ем усложнялась структурно-функциональная организация этих систем, шла селекция их компонент, рос энергетический потенциал, а на четвертом образовались живые клетки. Для каждого шага определены условия и движущие силы процессов саморазвития, структурно-функциональная организация и механизмы стойкости объектов эволюции. Данная теория присваивает целостность и завершенность научным представлениям об абиогенезе. Она способствует углублению знаний о строении живой материи, расширяет горизонты практической биологии и медицины.
ЧЕТЫРЕ Шага АБИОГЕНЕЗА
Введение.
Многие ученые утратили интерес к проблеме зарождения жизни, т.к. считают, что она фактически решена, и осталось только выяснить, что первично: отбор нуклеиновых кислот (ДНК, РНК), несущих генетическую информацию, или спонтанная концентрация ферментов, способных извлечь информацию из ДНК? По сути, это стандартная неувязка - «Курица или яйцо». Ни то, ни другое не объясняет происхождение живой материи, потому что чтение инфы, закодированной в ДНК, нереально без непрерывного воспроизводства похожих ферментов, которое, в свою очередь, нереально без чтения генетической инфы в процессе матричного синтеза белковых молекул.
Основываясь на современных заниях о хим составляющих и физических свойствах водоемов и атмосферы старенькой Земли, мы выстроили теоретическую модель зарождения жизни, акцентирующую внимание на предыстории молекулярных систем энергоснабжения. Согласно данной модели, биологически принципиальные цепочки поли-НК и глобулы полипептидов сначала отбирались в качестве компонент молекулярных пленок, поглощающих энергию Уф-излучения. Позже из этих пленок сформировалась многослойная структура, которая направляла УФ-энергию на синтез АТФ и других молекул-макроэргов. Ее каталитическая активность росла, что привело к появлению в ее внутренней среде изолированных участков, различавшихся по хим составу. После этого сформировались условия для начала матричного синтеза РНК и полипептидов. Так зародились 1-ые живые клетки, с генетической информацией и круглосуточным метаболизмом.
Шаг 1
Около 4 миллиардов лет назад на Земле появились водоемы, в каких образовался так называемый первичный бульон. В нем имелись многие органические соединения: аминокислоты, азотистые основания, нуклеотиды, нуклеиновые кислоты… Возможность их синтеза при нагревании, электрических разрядах, облучении подтверждена экспериментально [2, 3]. Древняя атмосфера не содержала кислород и пропускала Уф-излучение в диапазоне 240 - 260 nm, поглощаемое многими органическими соединениями. Под воздействием УФ-света в некоторых из этих молекул происходили различные структурные преобразования, характер которых зависел от внутримолекулярных и межмолекулярных переносов энергии. Необходимо установить, какие переносы энергии способствовали селекции органических молекул первичного бульона.
Среди 60-х годов был открыт триплет-экситонный перенос энергии в нуклеиновых кислотах [4, 6, 7]. Такой процесс начинается, когда одно из азотистых оснований в составе полинуклеотидной цепи РНК или ДНК поглощает УФ-свет (254нм). Оно переходит в возбужденное триплетное состояние, после чего передает энергию примыкающему основанию, а само возвращается в невозбужденное состояние. Перенос энергии по цепи идет при совпадении квантовых характеристик примыкающих азотистых оснований и не плохих расстояниях меж ними. Такие условия выполняются в био РНК или ДНК, состоящей из стандартного набора 4 азотистых оснований - А, Г, Ц, У (Т), соединенных 3'-5'-связями. Экспериментально доказано [6, 7] что в тех нуклеиновых кислотах, у каких имеются неоднородности первичной структуры, триплет-экситонный перенос ведет к деструктуризации, происходящей не в точках УФ-поглощения, а в участках с внутренней расположенностью.
В старенькых водоемах имелись поли-НК с различной первичной структурой. При поглощении УФ-света те их кусочки, в каких беспрепятственно шел триплет-экситонный перенос энергии, оставались неизменными, т.е. были устойчивы к действию УФ-света. Другие подвергались репарациям и конформационным изменениям. Из их могли создаваться новые устойчивые цепочки. Таким способом росло число молекул РНК, похожих по нюансу эффективности энергопереносов.
Принципно учитывать, что устойчивость УФ-облученных поли-НК зависит не только от упорядоченного внутримолекулярного переноса, ну и от оттока энергии вовне. У органических молекул, находящихся в аква среде, отток энергии реализуется при индуктивно-резонансных взаимодействиях, для которых требуется, чтобы расстояние меж донором энергии и акцептором не превышало некую пороговую величину (около 100А), а спектральная полоса флюоресценции донора перекрывалась с полосой поглощения акцептора. Многие органические соединения первичного бульона имели подходящие спектральные полосы поглощения, но их роли в индуктивно-резонансных переносах в качестве акцепторов энергии мешала дистанция меж ними и УФ-активированной РНК. В живых клетках сближение молекул-доноров с молекулами-акцепторами при индуктивно-резонансных переносах обеспечивают ферменты. Они формируются из полипептидов, синтезируемых матричным способом, которые имеют заданную первичную, вторичную и третичную структуру. Без массированного матричного синтеза таких полипептидов ферментативные процессы невозможны.
В первичном бульоне не было полноценных ферментов, но там имелись разнородные «дикие» полипептиды. При контактах с УФ-активированной РНК, они сами исполняли роль акцепторов индуктивно-резонансных переносов и подвергались энергетическим воздействиям, меняющим их первичную, а с ней и третичную структуру. Мы представили, что, несмотря на хаотичность таких переструктурирований, у некоторых из полипептидов появлялись схожие активные центры, которые позволяли им присоединять подходящие молекулы-субстраты и задерживать их в зонах индуктивно-резонансных переносов в качестве акцепторов энергии. Вместе с цепочками РНК, поглощавшими УФ-кванты и служившими донорами энергии, эти полипептиды составляли устойчивые нуклеопротеидные комплексы, которые передавали энергию сродственным молекулам-субстратам, и, тем, инициировали фотокаталитические преобразования их структур. (Рис. 1).
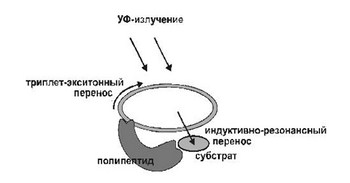
Рис. 1. Фотокаталитический комплекс.
Реализуя фотокатализ в составе устойчивых нуклеопротеидных комплексов, полипептиды получали защиту от новых переструктурирований. Отбор функционально схожих полипептидов, применимых для фотокатализа, шел под давлением УФ-света. Если по какой-либо причине полипептиды теряли субстратную специфичность, подходящую для фотокатализа, они возвращались к роли акцепторов энергии. На данный момент они вновь подвергались структурным изменениям, по этому могли вернуть свою субстратную специфичность.
На устойчивость фотокаталитических комплексов, образовавшихся в первичном бульоне, влияло их размещение в аква среде, ориентация к сгустку УФ-света. Здесь большущее селективное преимущество давало формирование плавающих пленок, которые состояли не только из УФ-поглощающих и субстратсвязующих, ну и из соединительных частей. Роль последних делали липиды, способные спонтанно создавать пленочные конструкции.
Если РНК, входившие в состав фотокаталитических комплексов, имели кольцеобразную вторичную структуру, то в их шла циркуляция триплет-экситонов. Это удлиняло время взаимодействия с молекулами-акцепторами, и энергия УФ-света передавалась акцепторам импульсами по принципу автоколебаний. Кольца РНК доминировали при сборке устойчивых комплексов и пленок, а другие полинуклеотиды, оставаясь вне комплексов, не обеспечивались акцепторами энергии и сами подвергались УФ-индуцированным деструкциям.
Нуклеопротеидные комплексы, подобные зародившимся в первичном бульоне, играют ведомую роль в каталитических системах всех живых клеток. Это «кирпичики» живой материи. Отметим, что одним из принципиальных характеристик живой материи является динамичность. В клетках постоянно идет распад и самосборка многих субструктур, имеющих метастабильные межмолекулярные связи, сохраняющиеся за счет диссипации энергии. В старенькых фотокаталитических комплексах также имелись метастабильные связи полипептидов с поли-НК, сохранявшиеся исключительно в процессе активной энергопередачи при фотокатализе. Поэтому ночью эти комплексы распадались, а днем повторяли самосборку. Цикличность, подчиненная суточному ритму, увеличивала их изменчивость, ускоряла отбор.
Шаг 2
Для фотокаталитических макромолекулярных пленок, выросших в первичных водоемах, УФ-свет стал не повреждающим фактором, а необходимым условием ежедневной самосборки, источником возобновления их метастабильных межмолекулярных связей. Когда эти пленки располагались в несколько слоев, только верхние всасывали ультрафиолет, а нижние, затененные испытывали недочет энергии и распадались. Для их стойкости требовался перенос энергии из верхних слоев.
Во всех живых клетках переносчиками энергии служат молекулы-макроэрги: АТФ, ГТФ и др. Они производятся, или окислительным фосфорилированием, использующим хим энергию различных органических соединений, или фотофосфорилированием, когда органические фосфаты синтезируются за счет энергии видимого света. И 1-ый, и 2-ой способ неосуществим без ферментов, обретенных матричным способом.
Так как на заре абиогенеза доминировал не видимый свет, а более действующий ультрафиолет, фотофосфорилирование могло обходиться без подлинных ферментов. Мы представили, что его начали создавать уже знакомые нам фотокаталитические комплексы, когда их субстратсвязующие составляющие (полипептиды) заполучили сродство с имевшимися в аква среде молекулами АДФ (или ГДФ и др.). В конечном итоге, эти молекулы в качестве субстратов удерживались в зоне индуктивно-резонансной энергопередачи, где энергия УФ-света, поглощенная и трансформированная в хим энергию кольцеобразной цепочкой РНК, направлялась на присоединение к ним неорганических фосфатов, т.е. на формирование макроэргов АТФ и др. Благодаря появлению УФ-зависимого фотофосфорилирования, началась диффузия макроэргов из верхних слоев в нижние. Она обеспечила их хим энергией и открыла перспективу грядущего усложнения. (Рис. 2).
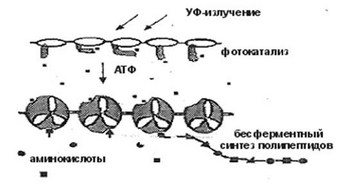
Рис. 2. Многослойный пробионт.
Устойчивые молекулярные комплексы, ответственные за фотофосфорилирование располагались в верхних нуклеопротеидных пленках, поглощавших УФ-свет. Они снабжали водную среду хим энергией в виде малекул-макроэргов. Но устойчивость молекулярных комплексов нижнего уровня, лишенных притока УФ-света, зависела не только от притока энергии, ну и от ее действующего расходования. Чтобы длительное время сохранять метастабильные связи собственных макромолекулярных компонент, эти комплексы должны были расходовать поступающую энергию, направлять ее на определенные хим процессы. Для выполнения такой работы им требовалась структурная модернизация. Мы представили, что нуклеопротеидные комплексы нижнего уровня заполучили устойчивость, когда в их состав вошли, во-1-х, АТФ-специфичные полипептиды, связывающие и удерживающие малекулы-макроэрги, а во-2-х, поли-НК с усложнившейся вторичной структурой, ответственные за перенос хим энергии к новым активным центрам.
Но на данном шаге абиогенеза так масштабной модернизации макромолекулярных структур препятствовал предел строй материалов, в особенности полипептидов. В живых клетках полипептиды синтезируются матричным способом при участии рибосом, иРНК, тРНК, в состав которых, совместно с ферментами, входят цепочки РНК типа «Клеверный лист», имеющие несколько кольцеобразных участков вторичной структуры. Источником энергии служит АТФ. Пробионты не располагали ферментами, поэтому матричный синтез был неосуществим. Но в их могла идти безматричная полимеризация полипептидов из аминокислот. Дело в том, что в их верхних слоях уже производились носители энергии: АТФ и др., а в нижних, защищенных от ультрафиолета, спонтанно появлялись различные РНК с вторичной структурой типа «Клеверный лист». Такие РНК врубались в нуклеопротеидные комплексы, содержащие несколько полипептидных компонент, субстратспецифичных, как к АТФ, так и к различным аминокислотам, присутствовавшим в аква среде. Эти комплексы использовали энергию, полученную от гидролиза АТФ, для соединение аминокислот пептидными связями. В конечном итоге осуществлялся безматричный синтез новых полипептидов.
Появления безматричного синтеза полипептидов дало многослойным макромолекулярным структурам перспективу роста, за счет самообеспечения полипептидным сырьем. Отметим, что очередность аминокислот в синтезированных полипептидах не имела решающего значения. Ведь из их не формировались готовые ферменты с данными свойствами. Свою субстратную специфичность они получали за счет переструктурирований, выступая в роли акцепторов энергии индуктивно-резонансных переносов.
На этом шаге затенение нижних слоев из помехи превратился в обязательное условие стойкости многослойных макромолекулярных структур. У их появилось автономное энергоснабжение и специализация верхних и нижних каталитических комплексов. Схожие многослойные образования, реализующие переносы хим энергии, являются необходимыми компонентами всех живых клеток.
Шаг 3
Как уже отмечалось, для роста нижних, защищенных от УФ-света, участков пробиотических пленок требовались РНК со сложной вторичной структурой типа «Клеверный лист», которые, в отличие от обыденных колец поли-НК, не формировались в процессе УФ-поглощения и триплет-эксмтонного переноса, а создавались спонтанно. Их недочет в старенькых водоемах лимитировал сборку нуклеопротеидных комплексов, способных продуктивно использовать энергию молекул-макроэргов. В таких аспектах приток АТФ к нижним слоям из созидательной силы мог стать вероятным источником разрушения.
В живых клетках цепочки РНК с данной структурой синтезируются на матрицах ДНК при участии многих ферментов. Этот процесс называется «Транскрипция». Он начинается разделением 2-ух цепей спирали ДНК. После чего одна цепь служит матрицей для синтеза РНК, а на другой воспроизводится парная (комплиментарная) ДНК, что позволяет повторно копировать ее информацию.
К третьему шагу генезиса пробионтов уже имелся ряд предпосылок возникновения молекулярных систем транскрипции. Выполнялось фотофосфорилирование, обеспечившие приток АТФ, ГТФ и других макроэргов, представляющих из себя строительный материал для сборки новых цепочек РНК и ДНК. В многослойных пробионтах спонтанно появлялись кусочки двухцепочечных спиралей ДНК - будущие матрицы. Но потому что еще не было ферментов, требовались другие предпосылки, управлявшие разделением 2-ух цепей ДНК, синтезом РНК и воспроизводством спаренной ДНК.
Понятно, что в живых клетках разделение двойной спирали ДНК, инициирующее транскрипцию, происходит при изменении основности (pH) аква среды. А молекулы ДНК и РНК образуются в средах с разным значением pH. Мы представили, что и пробионтам для транскрипции требовался перепад pH в примыкающих участках их внутренней аква среды, так называемая компартментализация. Ее предпосылкой был перенос протонов через каталитически активные надмолекулярной пленки - протомембраны. Транскрипция начиналась с роста pH в одном из компартментов пробионта и разделения двойной цепи ДНК. Одна одинарная цепь ДНК, проникая через протомембрану, попадала в примыкающий компартмент с низкой основностью, способствующей синтезу РНК. Она использовалась в качестве матрицы транскрипции. 2-ая одинарная ДНК оставалась в прежнем компартменте и служила матрицей для репликации ДНК и сборки двойной спирали, применимой для повторных транскрипций. (Рис. 3).
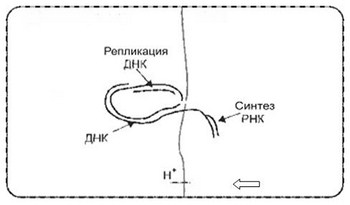
Рис. 3. Бесферментная транскрипция.
Благодаря селекции умеренно изменялся состав двойных цепочек ДНК в пробионтах, совершенствовалось качество и количество синтезируемых РНК. Росла согласованность всех каталитических процессов. Тот факт, что компартментализация внутренней среды возможна только при очень малых объемах компартментов, указывает на микроскопические размеры пробионтов третьего шага абиогенеза.
Протомембраны, обеспечившие перенос протонов в абиотических аспектах, были устроены значительно проще, на данный момент имеющихся биомембран. Их детализированное моделирование или искусственный синтез мог бы способствовать углублению научных представлений о трансмембранных переносах ионов и так называемых протонных насосах. Интересно, что в клетках прокариотических организмов (бактерий), как и в пробионтах, кольцевая молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У их встречаются также мелкие автономные кольцевые молекулы ДНК, называемые плазмидами.
Шаг 4
Так как УФ-энергия поступала только днем, ночью метаустойчивые пробионты распадались, а каждое утро рождались заново. После третьего шага их структурно-функциональная организация так усложнилась, что они не успевали полноценно восстанавливаться в течение светового дня. Это стало еще одним эволюционным препятствием, преодолеть которое могли организмы, живущие круглые день, а значит владеющие ночным энергоснабжением.
У живых клеток есть ферментативные системы окислительного фосфорилирования, не зависяшие от освещения. Они делают молекулы-макроэрги (АТФ и др.), используя хим энергию, получаемую при частичном окислении различных органических соединений. Понятно, что без ферментов, синтезированных матричным способом, они не работают и окислительное фосфорилирование нереально. Как надо, переход пробионтов к круглосуточной жизни зависел от появления матричного синтеза полипептидов, источника ферментов.
На 3-ем шаге абиогенеза у пробионтов уже сформировались молекулярные системы безматричного синтеза полипептидов, состоящие из нуклеопротеидных комплексов, субстратспецифичных относительно аминокислот и макроэргов. Имелись системы транскрипции - синтеза РНК на матрицах ДНК. Для начала матричного синтеза полипептидов не доставало головного - генетического кода. По сути, для его появления требовалась малая, но принципиально принципная инновация - перевоплощение уже имеющихся нуклеопротеидных комплексов, обладавших неспецифичным сродством с аминокислотами, в спец тРНК, наделенные активными центрами с избирательным сродством относительно различных типов аминокислот.
Пробы избирательного связывания аминокислот при полимеризации полипептидов могли продолжаться миллионы лет без существенного воздействия на эволюцию пробионтов. Но, как таким способом были синтезированы 1-ые ферменты, способные направлять энергию от окисления каких-либо органических соединений на фосфорилирование, т.е. на создание АТФ и других макроэргов, генетический код и матричный синтез заполучили селективную ценность. Пробионты получили круглосуточное энергоснабжение, превратился в живые организмы. Главным нюансом отбора стало качество и количество синтезируемых полипептидов, их включение в различные биокаталитические процессы. Можно представить, что сначала синтезировался некий 1-ый фермент, который катализировал окисление только 1-го имеющегося в среде органического соединения, сопряженное с переносом неорганического фосфата на АДФ. Одно это позволило пробионтам не распадаться ночью. К тому времени, когда запасы данного органического сырья истощились, арсенал полипептидов, синтезируемых матричным способом, значительно вырос. Некоторые из их вошли в состав рибосом, иРНК и тРНК, по этому возросла точность и эффективность биосинтеза самих полипептидов. Из других полипептидов формировались новые ферменты для системы окислительного фосфорилирования, удлиняющие ее каталитические цепи. Это позволило живым организмам получать хим энергию из многих органических соединений аква среды.
1-ый генетический код был значительно проще современного. Он обеспечивал только грубое кодирование некоторых аминокислот, ну и это сказалось на свойствах синтезированных полипептидов. Может быть первичные рибосомы, начавшие матричный синтез полипептидов, представляли собой глобулы из нуклеопротеидных комплексов, в каких кодон-антикодоновое соответствие иРНК и тРНК контролировалось переносами энергии в их сопряженных участках. Может быть, те же энерго процессы присущи всем рибосомам и могут быть выявлены экспериментально.
Круглосуточное энергоснабжение дало старт гиперциклическим сетям каталитических реакций, благодаря которым усовершенствование одной из субсистем клетки способствует модернизации других субсистем [5]. Гиперциклы обеспечили быстрое увеличение генетического материала, генерализацию матричных процессов, рост арсенала ферментов. Образовались системы ферментативного биосинтеза аминокислот, пигментов, полисахаридов... Появились цитоплазматические мембраны, истинные рибосомы и т.д. Живые клетки перешли от УФ-зависимого фотофосфорилирования к фотосинтезу в видимом диапазоне и заселили глубины водоемов, лишенные УФ-света, а после скопления атмосферного кислорода, поглощающего ультрафиолет, и сушу.
Процесс зарождения жизни включал четыре взаимосвязанных шага. На 3-х первых свойства пробионтов строго детерминировались аспектами среды, менявшимися под воздействием пробионтов. На четвертом образовались живые клетки, способные приспособиться к разным средам. У клеток появились ферментативные механизмы реагирования на внешние стимулы, с помощью которых они изменяют свой метаболизм и управляют движением клеточных оболочек, жгутиков или других подвижных частей. Клетки разных организмов отличаются спектрами реакций.
ЛИТЕРАТУРА
1. Каценберг М.М. От молекул к клетке, Природа, М, 1990, 11: 11 – 17.
2. Понамперума С.В. Происхождение предбиологических систем. Под ред. А.И. Опарина. М.: Мир.1966,. 224.
3. Саган К.В. Там же, 211.
4. Сверхкороткие световые импульсы. Под ред. С. Шапиро, М., 1981, 462.
5. Эйген, М. Шустер, П. Гиперцикл. М., 1982.
6. DNA fluorescence at room temperature exited by means of tye laser. /Chem.Phys.Lett. 1971, 81(2): 270-272.
7. Intramolecular triplet-triple energy transfer: delayed fluorescence in poly-L-tyrosine and polyadenylic acid. /Photochem. Photobiol. 1970, 11: 207
Похожие статьи:
 КАК ЗАРОДИЛАСЬ ЖИЗНЬ?
Резюме:
Построена новая теория зарождения жизни на Земле, согласно которой переход от разнородных органических молекул к первым живым организмам включал четыре взаимосвязанных эволюционных шага. На первом шаге формировались молекулярные системы, преобразующие энергию Уф-излучения в хим энергию, на втором и 3-ем усложнялась структурно-функциональная организация этих систем, шла селекция их компонент, рос энергетический потенциал, а на четвертом образовались живые клетки. Для каждого шага определены условия и движущие силы процессов саморазвития, структурно-функциональная организация и механизмы стойкости объектов эволюции. Данная теория присваивает целостность и завершенность научным представлениям об абиогенезе. Она способствует углублению знаний о строении живой материи, расширяет горизонты практической биологии и медицины.
ЧЕТЫРЕ Шага АБИОГЕНЕЗА
Введение.
Многие ученые утратили интерес к проблеме зарождения жизни, т.к. считают, что она фактически решена, и осталось только выяснить, что первично: отбор нуклеиновых кислот (ДНК, РНК), несущих генетическую информацию, или спонтанная концентрация ферментов, способных извлечь информацию из ДНК? По сути, это стандартная неувязка - «Курица или яйцо». Ни то, ни другое не объясняет происхождение живой материи, потому что чтение инфы, закодированной в ДНК, нереально без непрерывного воспроизводства похожих ферментов, которое, в свою очередь, нереально без чтения генетической инфы в процессе матричного синтеза белковых молекул.
Основываясь на современных заниях о хим составляющих и физических свойствах водоемов и атмосферы старенькой Земли, мы выстроили теоретическую модель зарождения жизни, акцентирующую внимание на предыстории молекулярных систем энергоснабжения. Согласно данной модели, биологически принципиальные цепочки поли-НК и глобулы полипептидов сначала отбирались в качестве компонент молекулярных пленок, поглощающих энергию Уф-излучения. Позже из этих пленок сформировалась многослойная структура, которая направляла УФ-энергию на синтез АТФ и других молекул-макроэргов. Ее каталитическая активность росла, что привело к появлению в ее внутренней среде изолированных участков, различавшихся по хим составу. После этого сформировались условия для начала матричного синтеза РНК и полипептидов. Так зародились 1-ые живые клетки, с генетической информацией и круглосуточным метаболизмом.
Шаг 1
Около 4 миллиардов лет назад на Земле появились водоемы, в каких образовался так называемый первичный бульон. В нем имелись многие органические соединения: аминокислоты, азотистые основания, нуклеотиды, нуклеиновые кислоты… Возможность их синтеза при нагревании, электрических разрядах, облучении подтверждена экспериментально [2, 3]. Древняя атмосфера не содержала кислород и пропускала Уф-излучение в диапазоне 240 - 260 nm, поглощаемое многими органическими соединениями. Под воздействием УФ-света в некоторых из этих молекул происходили различные структурные преобразования, характер которых зависел от внутримолекулярных и межмолекулярных переносов энергии. Необходимо установить, какие переносы энергии способствовали селекции органических молекул первичного бульона.
Среди 60-х годов был открыт триплет-экситонный перенос энергии в нуклеиновых кислотах [4, 6, 7]. Такой процесс начинается, когда одно из азотистых оснований в составе полинуклеотидной цепи РНК или ДНК поглощает УФ-свет (254нм). Оно переходит в возбужденное триплетное состояние, после чего передает энергию примыкающему основанию, а само возвращается в невозбужденное состояние. Перенос энергии по цепи идет при совпадении квантовых характеристик примыкающих азотистых оснований и не плохих расстояниях меж ними. Такие условия выполняются в био РНК или ДНК, состоящей из стандартного набора 4 азотистых оснований - А, Г, Ц, У (Т), соединенных 3'-5'-связями. Экспериментально доказано [6, 7] что в тех нуклеиновых кислотах, у каких имеются неоднородности первичной структуры, триплет-экситонный перенос ведет к деструктуризации, происходящей не в точках УФ-поглощения, а в участках с внутренней расположенностью.
В старенькых водоемах имелись поли-НК с различной первичной структурой. При поглощении УФ-света те их кусочки, в каких беспрепятственно шел триплет-экситонный перенос энергии, оставались неизменными, т.е. были устойчивы к действию УФ-света. Другие подвергались репарациям и конформационным изменениям. Из их могли создаваться новые устойчивые цепочки. Таким способом росло число молекул РНК, похожих по нюансу эффективности энергопереносов.
Принципно учитывать, что устойчивость УФ-облученных поли-НК зависит не только от упорядоченного внутримолекулярного переноса, ну и от оттока энергии вовне. У органических молекул, находящихся в аква среде, отток энергии реализуется при индуктивно-резонансных взаимодействиях, для которых требуется, чтобы расстояние меж донором энергии и акцептором не превышало некую пороговую величину (около 100А), а спектральная полоса флюоресценции донора перекрывалась с полосой поглощения акцептора. Многие органические соединения первичного бульона имели подходящие спектральные полосы поглощения, но их роли в индуктивно-резонансных переносах в качестве акцепторов энергии мешала дистанция меж ними и УФ-активированной РНК. В живых клетках сближение молекул-доноров с молекулами-акцепторами при индуктивно-резонансных переносах обеспечивают ферменты. Они формируются из полипептидов, синтезируемых матричным способом, которые имеют заданную первичную, вторичную и третичную структуру. Без массированного матричного синтеза таких полипептидов ферментативные процессы невозможны.
В первичном бульоне не было полноценных ферментов, но там имелись разнородные «дикие» полипептиды. При контактах с УФ-активированной РНК, они сами исполняли роль акцепторов индуктивно-резонансных переносов и подвергались энергетическим воздействиям, меняющим их первичную, а с ней и третичную структуру. Мы представили, что, несмотря на хаотичность таких переструктурирований, у некоторых из полипептидов появлялись схожие активные центры, которые позволяли им присоединять подходящие молекулы-субстраты и задерживать их в зонах индуктивно-резонансных переносов в качестве акцепторов энергии. Вместе с цепочками РНК, поглощавшими УФ-кванты и служившими донорами энергии, эти полипептиды составляли устойчивые нуклеопротеидные комплексы, которые передавали энергию сродственным молекулам-субстратам, и, тем, инициировали фотокаталитические преобразования их структур. (Рис. 1).
КАК ЗАРОДИЛАСЬ ЖИЗНЬ?
Резюме:
Построена новая теория зарождения жизни на Земле, согласно которой переход от разнородных органических молекул к первым живым организмам включал четыре взаимосвязанных эволюционных шага. На первом шаге формировались молекулярные системы, преобразующие энергию Уф-излучения в хим энергию, на втором и 3-ем усложнялась структурно-функциональная организация этих систем, шла селекция их компонент, рос энергетический потенциал, а на четвертом образовались живые клетки. Для каждого шага определены условия и движущие силы процессов саморазвития, структурно-функциональная организация и механизмы стойкости объектов эволюции. Данная теория присваивает целостность и завершенность научным представлениям об абиогенезе. Она способствует углублению знаний о строении живой материи, расширяет горизонты практической биологии и медицины.
ЧЕТЫРЕ Шага АБИОГЕНЕЗА
Введение.
Многие ученые утратили интерес к проблеме зарождения жизни, т.к. считают, что она фактически решена, и осталось только выяснить, что первично: отбор нуклеиновых кислот (ДНК, РНК), несущих генетическую информацию, или спонтанная концентрация ферментов, способных извлечь информацию из ДНК? По сути, это стандартная неувязка - «Курица или яйцо». Ни то, ни другое не объясняет происхождение живой материи, потому что чтение инфы, закодированной в ДНК, нереально без непрерывного воспроизводства похожих ферментов, которое, в свою очередь, нереально без чтения генетической инфы в процессе матричного синтеза белковых молекул.
Основываясь на современных заниях о хим составляющих и физических свойствах водоемов и атмосферы старенькой Земли, мы выстроили теоретическую модель зарождения жизни, акцентирующую внимание на предыстории молекулярных систем энергоснабжения. Согласно данной модели, биологически принципиальные цепочки поли-НК и глобулы полипептидов сначала отбирались в качестве компонент молекулярных пленок, поглощающих энергию Уф-излучения. Позже из этих пленок сформировалась многослойная структура, которая направляла УФ-энергию на синтез АТФ и других молекул-макроэргов. Ее каталитическая активность росла, что привело к появлению в ее внутренней среде изолированных участков, различавшихся по хим составу. После этого сформировались условия для начала матричного синтеза РНК и полипептидов. Так зародились 1-ые живые клетки, с генетической информацией и круглосуточным метаболизмом.
Шаг 1
Около 4 миллиардов лет назад на Земле появились водоемы, в каких образовался так называемый первичный бульон. В нем имелись многие органические соединения: аминокислоты, азотистые основания, нуклеотиды, нуклеиновые кислоты… Возможность их синтеза при нагревании, электрических разрядах, облучении подтверждена экспериментально [2, 3]. Древняя атмосфера не содержала кислород и пропускала Уф-излучение в диапазоне 240 - 260 nm, поглощаемое многими органическими соединениями. Под воздействием УФ-света в некоторых из этих молекул происходили различные структурные преобразования, характер которых зависел от внутримолекулярных и межмолекулярных переносов энергии. Необходимо установить, какие переносы энергии способствовали селекции органических молекул первичного бульона.
Среди 60-х годов был открыт триплет-экситонный перенос энергии в нуклеиновых кислотах [4, 6, 7]. Такой процесс начинается, когда одно из азотистых оснований в составе полинуклеотидной цепи РНК или ДНК поглощает УФ-свет (254нм). Оно переходит в возбужденное триплетное состояние, после чего передает энергию примыкающему основанию, а само возвращается в невозбужденное состояние. Перенос энергии по цепи идет при совпадении квантовых характеристик примыкающих азотистых оснований и не плохих расстояниях меж ними. Такие условия выполняются в био РНК или ДНК, состоящей из стандартного набора 4 азотистых оснований - А, Г, Ц, У (Т), соединенных 3'-5'-связями. Экспериментально доказано [6, 7] что в тех нуклеиновых кислотах, у каких имеются неоднородности первичной структуры, триплет-экситонный перенос ведет к деструктуризации, происходящей не в точках УФ-поглощения, а в участках с внутренней расположенностью.
В старенькых водоемах имелись поли-НК с различной первичной структурой. При поглощении УФ-света те их кусочки, в каких беспрепятственно шел триплет-экситонный перенос энергии, оставались неизменными, т.е. были устойчивы к действию УФ-света. Другие подвергались репарациям и конформационным изменениям. Из их могли создаваться новые устойчивые цепочки. Таким способом росло число молекул РНК, похожих по нюансу эффективности энергопереносов.
Принципно учитывать, что устойчивость УФ-облученных поли-НК зависит не только от упорядоченного внутримолекулярного переноса, ну и от оттока энергии вовне. У органических молекул, находящихся в аква среде, отток энергии реализуется при индуктивно-резонансных взаимодействиях, для которых требуется, чтобы расстояние меж донором энергии и акцептором не превышало некую пороговую величину (около 100А), а спектральная полоса флюоресценции донора перекрывалась с полосой поглощения акцептора. Многие органические соединения первичного бульона имели подходящие спектральные полосы поглощения, но их роли в индуктивно-резонансных переносах в качестве акцепторов энергии мешала дистанция меж ними и УФ-активированной РНК. В живых клетках сближение молекул-доноров с молекулами-акцепторами при индуктивно-резонансных переносах обеспечивают ферменты. Они формируются из полипептидов, синтезируемых матричным способом, которые имеют заданную первичную, вторичную и третичную структуру. Без массированного матричного синтеза таких полипептидов ферментативные процессы невозможны.
В первичном бульоне не было полноценных ферментов, но там имелись разнородные «дикие» полипептиды. При контактах с УФ-активированной РНК, они сами исполняли роль акцепторов индуктивно-резонансных переносов и подвергались энергетическим воздействиям, меняющим их первичную, а с ней и третичную структуру. Мы представили, что, несмотря на хаотичность таких переструктурирований, у некоторых из полипептидов появлялись схожие активные центры, которые позволяли им присоединять подходящие молекулы-субстраты и задерживать их в зонах индуктивно-резонансных переносов в качестве акцепторов энергии. Вместе с цепочками РНК, поглощавшими УФ-кванты и служившими донорами энергии, эти полипептиды составляли устойчивые нуклеопротеидные комплексы, которые передавали энергию сродственным молекулам-субстратам, и, тем, инициировали фотокаталитические преобразования их структур. (Рис. 1).
 Рис. 1. Фотокаталитический комплекс.
Реализуя фотокатализ в составе устойчивых нуклеопротеидных комплексов, полипептиды получали защиту от новых переструктурирований. Отбор функционально схожих полипептидов, применимых для фотокатализа, шел под давлением УФ-света. Если по какой-либо причине полипептиды теряли субстратную специфичность, подходящую для фотокатализа, они возвращались к роли акцепторов энергии. На данный момент они вновь подвергались структурным изменениям, по этому могли вернуть свою субстратную специфичность.
На устойчивость фотокаталитических комплексов, образовавшихся в первичном бульоне, влияло их размещение в аква среде, ориентация к сгустку УФ-света. Здесь большущее селективное преимущество давало формирование плавающих пленок, которые состояли не только из УФ-поглощающих и субстратсвязующих, ну и из соединительных частей. Роль последних делали липиды, способные спонтанно создавать пленочные конструкции.
Если РНК, входившие в состав фотокаталитических комплексов, имели кольцеобразную вторичную структуру, то в их шла циркуляция триплет-экситонов. Это удлиняло время взаимодействия с молекулами-акцепторами, и энергия УФ-света передавалась акцепторам импульсами по принципу автоколебаний. Кольца РНК доминировали при сборке устойчивых комплексов и пленок, а другие полинуклеотиды, оставаясь вне комплексов, не обеспечивались акцепторами энергии и сами подвергались УФ-индуцированным деструкциям.
Нуклеопротеидные комплексы, подобные зародившимся в первичном бульоне, играют ведомую роль в каталитических системах всех живых клеток. Это «кирпичики» живой материи. Отметим, что одним из принципиальных характеристик живой материи является динамичность. В клетках постоянно идет распад и самосборка многих субструктур, имеющих метастабильные межмолекулярные связи, сохраняющиеся за счет диссипации энергии. В старенькых фотокаталитических комплексах также имелись метастабильные связи полипептидов с поли-НК, сохранявшиеся исключительно в процессе активной энергопередачи при фотокатализе. Поэтому ночью эти комплексы распадались, а днем повторяли самосборку. Цикличность, подчиненная суточному ритму, увеличивала их изменчивость, ускоряла отбор.
Шаг 2
Для фотокаталитических макромолекулярных пленок, выросших в первичных водоемах, УФ-свет стал не повреждающим фактором, а необходимым условием ежедневной самосборки, источником возобновления их метастабильных межмолекулярных связей. Когда эти пленки располагались в несколько слоев, только верхние всасывали ультрафиолет, а нижние, затененные испытывали недочет энергии и распадались. Для их стойкости требовался перенос энергии из верхних слоев.
Во всех живых клетках переносчиками энергии служат молекулы-макроэрги: АТФ, ГТФ и др. Они производятся, или окислительным фосфорилированием, использующим хим энергию различных органических соединений, или фотофосфорилированием, когда органические фосфаты синтезируются за счет энергии видимого света. И 1-ый, и 2-ой способ неосуществим без ферментов, обретенных матричным способом.
Так как на заре абиогенеза доминировал не видимый свет, а более действующий ультрафиолет, фотофосфорилирование могло обходиться без подлинных ферментов. Мы представили, что его начали создавать уже знакомые нам фотокаталитические комплексы, когда их субстратсвязующие составляющие (полипептиды) заполучили сродство с имевшимися в аква среде молекулами АДФ (или ГДФ и др.). В конечном итоге, эти молекулы в качестве субстратов удерживались в зоне индуктивно-резонансной энергопередачи, где энергия УФ-света, поглощенная и трансформированная в хим энергию кольцеобразной цепочкой РНК, направлялась на присоединение к ним неорганических фосфатов, т.е. на формирование макроэргов АТФ и др. Благодаря появлению УФ-зависимого фотофосфорилирования, началась диффузия макроэргов из верхних слоев в нижние. Она обеспечила их хим энергией и открыла перспективу грядущего усложнения. (Рис. 2).
Рис. 1. Фотокаталитический комплекс.
Реализуя фотокатализ в составе устойчивых нуклеопротеидных комплексов, полипептиды получали защиту от новых переструктурирований. Отбор функционально схожих полипептидов, применимых для фотокатализа, шел под давлением УФ-света. Если по какой-либо причине полипептиды теряли субстратную специфичность, подходящую для фотокатализа, они возвращались к роли акцепторов энергии. На данный момент они вновь подвергались структурным изменениям, по этому могли вернуть свою субстратную специфичность.
На устойчивость фотокаталитических комплексов, образовавшихся в первичном бульоне, влияло их размещение в аква среде, ориентация к сгустку УФ-света. Здесь большущее селективное преимущество давало формирование плавающих пленок, которые состояли не только из УФ-поглощающих и субстратсвязующих, ну и из соединительных частей. Роль последних делали липиды, способные спонтанно создавать пленочные конструкции.
Если РНК, входившие в состав фотокаталитических комплексов, имели кольцеобразную вторичную структуру, то в их шла циркуляция триплет-экситонов. Это удлиняло время взаимодействия с молекулами-акцепторами, и энергия УФ-света передавалась акцепторам импульсами по принципу автоколебаний. Кольца РНК доминировали при сборке устойчивых комплексов и пленок, а другие полинуклеотиды, оставаясь вне комплексов, не обеспечивались акцепторами энергии и сами подвергались УФ-индуцированным деструкциям.
Нуклеопротеидные комплексы, подобные зародившимся в первичном бульоне, играют ведомую роль в каталитических системах всех живых клеток. Это «кирпичики» живой материи. Отметим, что одним из принципиальных характеристик живой материи является динамичность. В клетках постоянно идет распад и самосборка многих субструктур, имеющих метастабильные межмолекулярные связи, сохраняющиеся за счет диссипации энергии. В старенькых фотокаталитических комплексах также имелись метастабильные связи полипептидов с поли-НК, сохранявшиеся исключительно в процессе активной энергопередачи при фотокатализе. Поэтому ночью эти комплексы распадались, а днем повторяли самосборку. Цикличность, подчиненная суточному ритму, увеличивала их изменчивость, ускоряла отбор.
Шаг 2
Для фотокаталитических макромолекулярных пленок, выросших в первичных водоемах, УФ-свет стал не повреждающим фактором, а необходимым условием ежедневной самосборки, источником возобновления их метастабильных межмолекулярных связей. Когда эти пленки располагались в несколько слоев, только верхние всасывали ультрафиолет, а нижние, затененные испытывали недочет энергии и распадались. Для их стойкости требовался перенос энергии из верхних слоев.
Во всех живых клетках переносчиками энергии служат молекулы-макроэрги: АТФ, ГТФ и др. Они производятся, или окислительным фосфорилированием, использующим хим энергию различных органических соединений, или фотофосфорилированием, когда органические фосфаты синтезируются за счет энергии видимого света. И 1-ый, и 2-ой способ неосуществим без ферментов, обретенных матричным способом.
Так как на заре абиогенеза доминировал не видимый свет, а более действующий ультрафиолет, фотофосфорилирование могло обходиться без подлинных ферментов. Мы представили, что его начали создавать уже знакомые нам фотокаталитические комплексы, когда их субстратсвязующие составляющие (полипептиды) заполучили сродство с имевшимися в аква среде молекулами АДФ (или ГДФ и др.). В конечном итоге, эти молекулы в качестве субстратов удерживались в зоне индуктивно-резонансной энергопередачи, где энергия УФ-света, поглощенная и трансформированная в хим энергию кольцеобразной цепочкой РНК, направлялась на присоединение к ним неорганических фосфатов, т.е. на формирование макроэргов АТФ и др. Благодаря появлению УФ-зависимого фотофосфорилирования, началась диффузия макроэргов из верхних слоев в нижние. Она обеспечила их хим энергией и открыла перспективу грядущего усложнения. (Рис. 2).
 Рис. 2. Многослойный пробионт.
Устойчивые молекулярные комплексы, ответственные за фотофосфорилирование располагались в верхних нуклеопротеидных пленках, поглощавших УФ-свет. Они снабжали водную среду хим энергией в виде малекул-макроэргов. Но устойчивость молекулярных комплексов нижнего уровня, лишенных притока УФ-света, зависела не только от притока энергии, ну и от ее действующего расходования. Чтобы длительное время сохранять метастабильные связи собственных макромолекулярных компонент, эти комплексы должны были расходовать поступающую энергию, направлять ее на определенные хим процессы. Для выполнения такой работы им требовалась структурная модернизация. Мы представили, что нуклеопротеидные комплексы нижнего уровня заполучили устойчивость, когда в их состав вошли, во-1-х, АТФ-специфичные полипептиды, связывающие и удерживающие малекулы-макроэрги, а во-2-х, поли-НК с усложнившейся вторичной структурой, ответственные за перенос хим энергии к новым активным центрам.
Но на данном шаге абиогенеза так масштабной модернизации макромолекулярных структур препятствовал предел строй материалов, в особенности полипептидов. В живых клетках полипептиды синтезируются матричным способом при участии рибосом, иРНК, тРНК, в состав которых, совместно с ферментами, входят цепочки РНК типа «Клеверный лист», имеющие несколько кольцеобразных участков вторичной структуры. Источником энергии служит АТФ. Пробионты не располагали ферментами, поэтому матричный синтез был неосуществим. Но в их могла идти безматричная полимеризация полипептидов из аминокислот. Дело в том, что в их верхних слоях уже производились носители энергии: АТФ и др., а в нижних, защищенных от ультрафиолета, спонтанно появлялись различные РНК с вторичной структурой типа «Клеверный лист». Такие РНК врубались в нуклеопротеидные комплексы, содержащие несколько полипептидных компонент, субстратспецифичных, как к АТФ, так и к различным аминокислотам, присутствовавшим в аква среде. Эти комплексы использовали энергию, полученную от гидролиза АТФ, для соединение аминокислот пептидными связями. В конечном итоге осуществлялся безматричный синтез новых полипептидов.
Появления безматричного синтеза полипептидов дало многослойным макромолекулярным структурам перспективу роста, за счет самообеспечения полипептидным сырьем. Отметим, что очередность аминокислот в синтезированных полипептидах не имела решающего значения. Ведь из их не формировались готовые ферменты с данными свойствами. Свою субстратную специфичность они получали за счет переструктурирований, выступая в роли акцепторов энергии индуктивно-резонансных переносов.
На этом шаге затенение нижних слоев из помехи превратился в обязательное условие стойкости многослойных макромолекулярных структур. У их появилось автономное энергоснабжение и специализация верхних и нижних каталитических комплексов. Схожие многослойные образования, реализующие переносы хим энергии, являются необходимыми компонентами всех живых клеток.
Шаг 3
Как уже отмечалось, для роста нижних, защищенных от УФ-света, участков пробиотических пленок требовались РНК со сложной вторичной структурой типа «Клеверный лист», которые, в отличие от обыденных колец поли-НК, не формировались в процессе УФ-поглощения и триплет-эксмтонного переноса, а создавались спонтанно. Их недочет в старенькых водоемах лимитировал сборку нуклеопротеидных комплексов, способных продуктивно использовать энергию молекул-макроэргов. В таких аспектах приток АТФ к нижним слоям из созидательной силы мог стать вероятным источником разрушения.
В живых клетках цепочки РНК с данной структурой синтезируются на матрицах ДНК при участии многих ферментов. Этот процесс называется «Транскрипция». Он начинается разделением 2-ух цепей спирали ДНК. После чего одна цепь служит матрицей для синтеза РНК, а на другой воспроизводится парная (комплиментарная) ДНК, что позволяет повторно копировать ее информацию.
К третьему шагу генезиса пробионтов уже имелся ряд предпосылок возникновения молекулярных систем транскрипции. Выполнялось фотофосфорилирование, обеспечившие приток АТФ, ГТФ и других макроэргов, представляющих из себя строительный материал для сборки новых цепочек РНК и ДНК. В многослойных пробионтах спонтанно появлялись кусочки двухцепочечных спиралей ДНК - будущие матрицы. Но потому что еще не было ферментов, требовались другие предпосылки, управлявшие разделением 2-ух цепей ДНК, синтезом РНК и воспроизводством спаренной ДНК.
Понятно, что в живых клетках разделение двойной спирали ДНК, инициирующее транскрипцию, происходит при изменении основности (pH) аква среды. А молекулы ДНК и РНК образуются в средах с разным значением pH. Мы представили, что и пробионтам для транскрипции требовался перепад pH в примыкающих участках их внутренней аква среды, так называемая компартментализация. Ее предпосылкой был перенос протонов через каталитически активные надмолекулярной пленки - протомембраны. Транскрипция начиналась с роста pH в одном из компартментов пробионта и разделения двойной цепи ДНК. Одна одинарная цепь ДНК, проникая через протомембрану, попадала в примыкающий компартмент с низкой основностью, способствующей синтезу РНК. Она использовалась в качестве матрицы транскрипции. 2-ая одинарная ДНК оставалась в прежнем компартменте и служила матрицей для репликации ДНК и сборки двойной спирали, применимой для повторных транскрипций. (Рис. 3).
Рис. 2. Многослойный пробионт.
Устойчивые молекулярные комплексы, ответственные за фотофосфорилирование располагались в верхних нуклеопротеидных пленках, поглощавших УФ-свет. Они снабжали водную среду хим энергией в виде малекул-макроэргов. Но устойчивость молекулярных комплексов нижнего уровня, лишенных притока УФ-света, зависела не только от притока энергии, ну и от ее действующего расходования. Чтобы длительное время сохранять метастабильные связи собственных макромолекулярных компонент, эти комплексы должны были расходовать поступающую энергию, направлять ее на определенные хим процессы. Для выполнения такой работы им требовалась структурная модернизация. Мы представили, что нуклеопротеидные комплексы нижнего уровня заполучили устойчивость, когда в их состав вошли, во-1-х, АТФ-специфичные полипептиды, связывающие и удерживающие малекулы-макроэрги, а во-2-х, поли-НК с усложнившейся вторичной структурой, ответственные за перенос хим энергии к новым активным центрам.
Но на данном шаге абиогенеза так масштабной модернизации макромолекулярных структур препятствовал предел строй материалов, в особенности полипептидов. В живых клетках полипептиды синтезируются матричным способом при участии рибосом, иРНК, тРНК, в состав которых, совместно с ферментами, входят цепочки РНК типа «Клеверный лист», имеющие несколько кольцеобразных участков вторичной структуры. Источником энергии служит АТФ. Пробионты не располагали ферментами, поэтому матричный синтез был неосуществим. Но в их могла идти безматричная полимеризация полипептидов из аминокислот. Дело в том, что в их верхних слоях уже производились носители энергии: АТФ и др., а в нижних, защищенных от ультрафиолета, спонтанно появлялись различные РНК с вторичной структурой типа «Клеверный лист». Такие РНК врубались в нуклеопротеидные комплексы, содержащие несколько полипептидных компонент, субстратспецифичных, как к АТФ, так и к различным аминокислотам, присутствовавшим в аква среде. Эти комплексы использовали энергию, полученную от гидролиза АТФ, для соединение аминокислот пептидными связями. В конечном итоге осуществлялся безматричный синтез новых полипептидов.
Появления безматричного синтеза полипептидов дало многослойным макромолекулярным структурам перспективу роста, за счет самообеспечения полипептидным сырьем. Отметим, что очередность аминокислот в синтезированных полипептидах не имела решающего значения. Ведь из их не формировались готовые ферменты с данными свойствами. Свою субстратную специфичность они получали за счет переструктурирований, выступая в роли акцепторов энергии индуктивно-резонансных переносов.
На этом шаге затенение нижних слоев из помехи превратился в обязательное условие стойкости многослойных макромолекулярных структур. У их появилось автономное энергоснабжение и специализация верхних и нижних каталитических комплексов. Схожие многослойные образования, реализующие переносы хим энергии, являются необходимыми компонентами всех живых клеток.
Шаг 3
Как уже отмечалось, для роста нижних, защищенных от УФ-света, участков пробиотических пленок требовались РНК со сложной вторичной структурой типа «Клеверный лист», которые, в отличие от обыденных колец поли-НК, не формировались в процессе УФ-поглощения и триплет-эксмтонного переноса, а создавались спонтанно. Их недочет в старенькых водоемах лимитировал сборку нуклеопротеидных комплексов, способных продуктивно использовать энергию молекул-макроэргов. В таких аспектах приток АТФ к нижним слоям из созидательной силы мог стать вероятным источником разрушения.
В живых клетках цепочки РНК с данной структурой синтезируются на матрицах ДНК при участии многих ферментов. Этот процесс называется «Транскрипция». Он начинается разделением 2-ух цепей спирали ДНК. После чего одна цепь служит матрицей для синтеза РНК, а на другой воспроизводится парная (комплиментарная) ДНК, что позволяет повторно копировать ее информацию.
К третьему шагу генезиса пробионтов уже имелся ряд предпосылок возникновения молекулярных систем транскрипции. Выполнялось фотофосфорилирование, обеспечившие приток АТФ, ГТФ и других макроэргов, представляющих из себя строительный материал для сборки новых цепочек РНК и ДНК. В многослойных пробионтах спонтанно появлялись кусочки двухцепочечных спиралей ДНК - будущие матрицы. Но потому что еще не было ферментов, требовались другие предпосылки, управлявшие разделением 2-ух цепей ДНК, синтезом РНК и воспроизводством спаренной ДНК.
Понятно, что в живых клетках разделение двойной спирали ДНК, инициирующее транскрипцию, происходит при изменении основности (pH) аква среды. А молекулы ДНК и РНК образуются в средах с разным значением pH. Мы представили, что и пробионтам для транскрипции требовался перепад pH в примыкающих участках их внутренней аква среды, так называемая компартментализация. Ее предпосылкой был перенос протонов через каталитически активные надмолекулярной пленки - протомембраны. Транскрипция начиналась с роста pH в одном из компартментов пробионта и разделения двойной цепи ДНК. Одна одинарная цепь ДНК, проникая через протомембрану, попадала в примыкающий компартмент с низкой основностью, способствующей синтезу РНК. Она использовалась в качестве матрицы транскрипции. 2-ая одинарная ДНК оставалась в прежнем компартменте и служила матрицей для репликации ДНК и сборки двойной спирали, применимой для повторных транскрипций. (Рис. 3).
 Рис. 3. Бесферментная транскрипция.
Благодаря селекции умеренно изменялся состав двойных цепочек ДНК в пробионтах, совершенствовалось качество и количество синтезируемых РНК. Росла согласованность всех каталитических процессов. Тот факт, что компартментализация внутренней среды возможна только при очень малых объемах компартментов, указывает на микроскопические размеры пробионтов третьего шага абиогенеза.
Протомембраны, обеспечившие перенос протонов в абиотических аспектах, были устроены значительно проще, на данный момент имеющихся биомембран. Их детализированное моделирование или искусственный синтез мог бы способствовать углублению научных представлений о трансмембранных переносах ионов и так называемых протонных насосах. Интересно, что в клетках прокариотических организмов (бактерий), как и в пробионтах, кольцевая молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У их встречаются также мелкие автономные кольцевые молекулы ДНК, называемые плазмидами.
Шаг 4
Так как УФ-энергия поступала только днем, ночью метаустойчивые пробионты распадались, а каждое утро рождались заново. После третьего шага их структурно-функциональная организация так усложнилась, что они не успевали полноценно восстанавливаться в течение светового дня. Это стало еще одним эволюционным препятствием, преодолеть которое могли организмы, живущие круглые день, а значит владеющие ночным энергоснабжением.
У живых клеток есть ферментативные системы окислительного фосфорилирования, не зависяшие от освещения. Они делают молекулы-макроэрги (АТФ и др.), используя хим энергию, получаемую при частичном окислении различных органических соединений. Понятно, что без ферментов, синтезированных матричным способом, они не работают и окислительное фосфорилирование нереально. Как надо, переход пробионтов к круглосуточной жизни зависел от появления матричного синтеза полипептидов, источника ферментов.
На 3-ем шаге абиогенеза у пробионтов уже сформировались молекулярные системы безматричного синтеза полипептидов, состоящие из нуклеопротеидных комплексов, субстратспецифичных относительно аминокислот и макроэргов. Имелись системы транскрипции - синтеза РНК на матрицах ДНК. Для начала матричного синтеза полипептидов не доставало головного - генетического кода. По сути, для его появления требовалась малая, но принципиально принципная инновация - перевоплощение уже имеющихся нуклеопротеидных комплексов, обладавших неспецифичным сродством с аминокислотами, в спец тРНК, наделенные активными центрами с избирательным сродством относительно различных типов аминокислот.
Пробы избирательного связывания аминокислот при полимеризации полипептидов могли продолжаться миллионы лет без существенного воздействия на эволюцию пробионтов. Но, как таким способом были синтезированы 1-ые ферменты, способные направлять энергию от окисления каких-либо органических соединений на фосфорилирование, т.е. на создание АТФ и других макроэргов, генетический код и матричный синтез заполучили селективную ценность. Пробионты получили круглосуточное энергоснабжение, превратился в живые организмы. Главным нюансом отбора стало качество и количество синтезируемых полипептидов, их включение в различные биокаталитические процессы. Можно представить, что сначала синтезировался некий 1-ый фермент, который катализировал окисление только 1-го имеющегося в среде органического соединения, сопряженное с переносом неорганического фосфата на АДФ. Одно это позволило пробионтам не распадаться ночью. К тому времени, когда запасы данного органического сырья истощились, арсенал полипептидов, синтезируемых матричным способом, значительно вырос. Некоторые из их вошли в состав рибосом, иРНК и тРНК, по этому возросла точность и эффективность биосинтеза самих полипептидов. Из других полипептидов формировались новые ферменты для системы окислительного фосфорилирования, удлиняющие ее каталитические цепи. Это позволило живым организмам получать хим энергию из многих органических соединений аква среды.
1-ый генетический код был значительно проще современного. Он обеспечивал только грубое кодирование некоторых аминокислот, ну и это сказалось на свойствах синтезированных полипептидов. Может быть первичные рибосомы, начавшие матричный синтез полипептидов, представляли собой глобулы из нуклеопротеидных комплексов, в каких кодон-антикодоновое соответствие иРНК и тРНК контролировалось переносами энергии в их сопряженных участках. Может быть, те же энерго процессы присущи всем рибосомам и могут быть выявлены экспериментально.
Круглосуточное энергоснабжение дало старт гиперциклическим сетям каталитических реакций, благодаря которым усовершенствование одной из субсистем клетки способствует модернизации других субсистем [5]. Гиперциклы обеспечили быстрое увеличение генетического материала, генерализацию матричных процессов, рост арсенала ферментов. Образовались системы ферментативного биосинтеза аминокислот, пигментов, полисахаридов... Появились цитоплазматические мембраны, истинные рибосомы и т.д. Живые клетки перешли от УФ-зависимого фотофосфорилирования к фотосинтезу в видимом диапазоне и заселили глубины водоемов, лишенные УФ-света, а после скопления атмосферного кислорода, поглощающего ультрафиолет, и сушу.
Процесс зарождения жизни включал четыре взаимосвязанных шага. На 3-х первых свойства пробионтов строго детерминировались аспектами среды, менявшимися под воздействием пробионтов. На четвертом образовались живые клетки, способные приспособиться к разным средам. У клеток появились ферментативные механизмы реагирования на внешние стимулы, с помощью которых они изменяют свой метаболизм и управляют движением клеточных оболочек, жгутиков или других подвижных частей. Клетки разных организмов отличаются спектрами реакций.
ЛИТЕРАТУРА
1. Каценберг М.М. От молекул к клетке, Природа, М, 1990, 11: 11 – 17.
2. Понамперума С.В. Происхождение предбиологических систем. Под ред. А.И. Опарина. М.: Мир.1966,. 224.
3. Саган К.В. Там же, 211.
4. Сверхкороткие световые импульсы. Под ред. С. Шапиро, М., 1981, 462.
5. Эйген, М. Шустер, П. Гиперцикл. М., 1982.
6. DNA fluorescence at room temperature exited by means of tye laser. /Chem.Phys.Lett. 1971, 81(2): 270-272.
7. Intramolecular triplet-triple energy transfer: delayed fluorescence in poly-L-tyrosine and polyadenylic acid. /Photochem. Photobiol. 1970, 11: 207
Рис. 3. Бесферментная транскрипция.
Благодаря селекции умеренно изменялся состав двойных цепочек ДНК в пробионтах, совершенствовалось качество и количество синтезируемых РНК. Росла согласованность всех каталитических процессов. Тот факт, что компартментализация внутренней среды возможна только при очень малых объемах компартментов, указывает на микроскопические размеры пробионтов третьего шага абиогенеза.
Протомембраны, обеспечившие перенос протонов в абиотических аспектах, были устроены значительно проще, на данный момент имеющихся биомембран. Их детализированное моделирование или искусственный синтез мог бы способствовать углублению научных представлений о трансмембранных переносах ионов и так называемых протонных насосах. Интересно, что в клетках прокариотических организмов (бактерий), как и в пробионтах, кольцевая молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У их встречаются также мелкие автономные кольцевые молекулы ДНК, называемые плазмидами.
Шаг 4
Так как УФ-энергия поступала только днем, ночью метаустойчивые пробионты распадались, а каждое утро рождались заново. После третьего шага их структурно-функциональная организация так усложнилась, что они не успевали полноценно восстанавливаться в течение светового дня. Это стало еще одним эволюционным препятствием, преодолеть которое могли организмы, живущие круглые день, а значит владеющие ночным энергоснабжением.
У живых клеток есть ферментативные системы окислительного фосфорилирования, не зависяшие от освещения. Они делают молекулы-макроэрги (АТФ и др.), используя хим энергию, получаемую при частичном окислении различных органических соединений. Понятно, что без ферментов, синтезированных матричным способом, они не работают и окислительное фосфорилирование нереально. Как надо, переход пробионтов к круглосуточной жизни зависел от появления матричного синтеза полипептидов, источника ферментов.
На 3-ем шаге абиогенеза у пробионтов уже сформировались молекулярные системы безматричного синтеза полипептидов, состоящие из нуклеопротеидных комплексов, субстратспецифичных относительно аминокислот и макроэргов. Имелись системы транскрипции - синтеза РНК на матрицах ДНК. Для начала матричного синтеза полипептидов не доставало головного - генетического кода. По сути, для его появления требовалась малая, но принципиально принципная инновация - перевоплощение уже имеющихся нуклеопротеидных комплексов, обладавших неспецифичным сродством с аминокислотами, в спец тРНК, наделенные активными центрами с избирательным сродством относительно различных типов аминокислот.
Пробы избирательного связывания аминокислот при полимеризации полипептидов могли продолжаться миллионы лет без существенного воздействия на эволюцию пробионтов. Но, как таким способом были синтезированы 1-ые ферменты, способные направлять энергию от окисления каких-либо органических соединений на фосфорилирование, т.е. на создание АТФ и других макроэргов, генетический код и матричный синтез заполучили селективную ценность. Пробионты получили круглосуточное энергоснабжение, превратился в живые организмы. Главным нюансом отбора стало качество и количество синтезируемых полипептидов, их включение в различные биокаталитические процессы. Можно представить, что сначала синтезировался некий 1-ый фермент, который катализировал окисление только 1-го имеющегося в среде органического соединения, сопряженное с переносом неорганического фосфата на АДФ. Одно это позволило пробионтам не распадаться ночью. К тому времени, когда запасы данного органического сырья истощились, арсенал полипептидов, синтезируемых матричным способом, значительно вырос. Некоторые из их вошли в состав рибосом, иРНК и тРНК, по этому возросла точность и эффективность биосинтеза самих полипептидов. Из других полипептидов формировались новые ферменты для системы окислительного фосфорилирования, удлиняющие ее каталитические цепи. Это позволило живым организмам получать хим энергию из многих органических соединений аква среды.
1-ый генетический код был значительно проще современного. Он обеспечивал только грубое кодирование некоторых аминокислот, ну и это сказалось на свойствах синтезированных полипептидов. Может быть первичные рибосомы, начавшие матричный синтез полипептидов, представляли собой глобулы из нуклеопротеидных комплексов, в каких кодон-антикодоновое соответствие иРНК и тРНК контролировалось переносами энергии в их сопряженных участках. Может быть, те же энерго процессы присущи всем рибосомам и могут быть выявлены экспериментально.
Круглосуточное энергоснабжение дало старт гиперциклическим сетям каталитических реакций, благодаря которым усовершенствование одной из субсистем клетки способствует модернизации других субсистем [5]. Гиперциклы обеспечили быстрое увеличение генетического материала, генерализацию матричных процессов, рост арсенала ферментов. Образовались системы ферментативного биосинтеза аминокислот, пигментов, полисахаридов... Появились цитоплазматические мембраны, истинные рибосомы и т.д. Живые клетки перешли от УФ-зависимого фотофосфорилирования к фотосинтезу в видимом диапазоне и заселили глубины водоемов, лишенные УФ-света, а после скопления атмосферного кислорода, поглощающего ультрафиолет, и сушу.
Процесс зарождения жизни включал четыре взаимосвязанных шага. На 3-х первых свойства пробионтов строго детерминировались аспектами среды, менявшимися под воздействием пробионтов. На четвертом образовались живые клетки, способные приспособиться к разным средам. У клеток появились ферментативные механизмы реагирования на внешние стимулы, с помощью которых они изменяют свой метаболизм и управляют движением клеточных оболочек, жгутиков или других подвижных частей. Клетки разных организмов отличаются спектрами реакций.
ЛИТЕРАТУРА
1. Каценберг М.М. От молекул к клетке, Природа, М, 1990, 11: 11 – 17.
2. Понамперума С.В. Происхождение предбиологических систем. Под ред. А.И. Опарина. М.: Мир.1966,. 224.
3. Саган К.В. Там же, 211.
4. Сверхкороткие световые импульсы. Под ред. С. Шапиро, М., 1981, 462.
5. Эйген, М. Шустер, П. Гиперцикл. М., 1982.
6. DNA fluorescence at room temperature exited by means of tye laser. /Chem.Phys.Lett. 1971, 81(2): 270-272.
7. Intramolecular triplet-triple energy transfer: delayed fluorescence in poly-L-tyrosine and polyadenylic acid. /Photochem. Photobiol. 1970, 11: 207







Комментарии