
Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то

Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то, что оно имеет отношение к аутоиммунным процессам. Международный консорциум учёных провёл крупномасштабное генетическое сканирование, которое выявило несколько генов, с неправильной работой которых может быть связано развитие заболевания. Правда, это пока только 1-ый шаг — о лечении и даже о точных молекулярных и клеточных механизмах исследователи пока сказать ничего не могут.
Витилиго (от лат. vitiligo — накожная болезнь, лишай) — хроническое болезнь, выражающееся поначалу в появлении участков депигментированной кожи, волосяной покров в каких также становится седым. Это явление вызвано нарушением работы меланоцитов — клеток, производящих пигменты кожи (поначалу, меланин), — из-за их нефункциональности или даже просто погибели. Витилиго имеет аутоиммунную природу — другими словами, меланоциты гибнут из-за сбоя определения в системе клеточного иммунитета, когда свои собственные «тканевые стражи» (макрофаги, лимфоциты) начинают атаковать меланоциты и выводить их из строя. Витилиго часто сопровождается другими аутоиммунными заболеваниями, — например, тиреоидитом или системной красной волчанкой. Предварительные исследования показали, что генетические недочеты, вызывающие витилиго, в основном относятся к генам иммунной системы, также к генам самих меланоцитов.
Это болезнь, в общем-то, не опасно, но оно портит внешность человека. Широко известна история, когда поп-король Майкл Джексон, сначало темнокожий, умеренно превратился в «белого человека». Эта метаморфоза продолжительно обсасывалась бульварной прессой, но, по-видимому, перевоплощение было вызвано не расовыми убеждениями или чем-то более экстравагантным, а непосредственно витилиго, 1-ые признаки которого появились у певца поначалу 1980-х. Именитая белая перчатка с блёстками, ставшая объектом подражания многочисленных имитаторов, служила для сокрытия начинающейся заболевания, когда ладонь темнокожего артиста стала белеть. Позже, когда перчатка и грим окончили помогать, Джексон делал пластические операции для выравнивания общего оттенка кожи, — тогда, уже фактически белой. В диагнозе «короля» считается также и системная красная волчанка.

Именитая белая перчатка с блёстками поп-короля Майкла Джексона — видимо, только попытка замаскировать прогрессирующее развитие витилиго. Картина: Википедия.
Исцеления витилиго не существует; есть только частичные меры, позволяющие замедлить развитие заболевания или уменьшить его внешние проявления. Поначалу, больным необходимо использовать сильные солнцезащитные крем&覙, потому что кожа, лишённая естественного фотофильтра, очень быстро сгорает на солнце, и в ней под действием ультрафиолетовых лучей даже может начать развиваться онкология. Вобщем, ультрафиолет диапазонов A и B употребляют и для терапии витилиго, но, естественно, в контролируемых клинических аспектах. Не считая обыденных косметических составов, только разглаживающих тон кожи, часто употребляют мази с кортикостероидами, которые в ряде различных случаев могут частично возвратить пигментацию. Не считая того, известны случаи удачной терапии кандаловём «подсаживания» в поражённую область «своих» меланоцитов с участка здоровой кожи, размноженных в искусственных аспектах. Не считая этого, есть данные об исцелении заболевания массой препаратов, обретенных из природных источников — чёрного перца, гинкго и даже человеческой плаценты, но эти результаты нельзя называть принятыми и широко распространёнными в мед и косметической практике.
Очевидно, что по-настоящему действующего способа исцеления не будет, пока не станут известны точные механизмы возникновения заболевания — другими словами, что непосредственно происходит на уровне отдельных клеток, когда уничтожаются свои собственные меланоциты, и что является предпосылкой этой «междоусобицы». В наш век постгеномных технологий [1] принято подходить к исследованию генетической подоплёки заболеваний достаточно формально — генотипируя большие группы пациентов с этой болезнью и сравнивая результаты с «контрольной» группой (состоящей из здоровых людей). При всем этом, чтобы ничего не упустить, недочеты ищут по всему геному, сравнивая отличия в сотках тысяч мест по всем хромосомам.
Примерный размер генома человека — три миллиардов пар оснований, но большая часть этого материала идентична не только для всех 2-ух людей, ну и, скажем, для человека и шимпанзе (или даже мыши). Основная масса различий кроется в так называемых однонуклеотидных заменах (или снипах — от SNP, single nucleotid polymorphism) — различиях в отдельных «буквах», составляющих «слово» (ген). При всем этом варианты 1-го гена, отличающиеся по одной (или нескольким) таким «буквам», будут называться аллельными.
Кстати, подавляющее количество снипов находится не в границах генов, кодирующих белки (которых всего-то чуть больше 20 тысяч [2]), а в «межгенных пространствах», составляющих основную массу ДНК. Роль этой «тёмной материи» ещё совсем не так издавна представлялась так непонятной, что эти области даже называли «мусорной ДНК» [3], но на сей день накопилась уже масса свидетельств тому, что этот «балласт» на самом деле делает принципиальные регуляторные функции. Кстати, может быть, что именно эта ДНК играет решающую роль в эволюции организмов и определяет отличие, например, меж человеком и остальными приматами [4].
Так или по другому, несмотря на медленное, но неотвратимое приближение эры «персональной геномики», когда каждый человек вместе со свидетельством о рождении будет получать и мед карту с полной последовательностью собственного генома [5], сейчас мед генетики сравнивают меж собой не целые геномы, а только наборы снипов, соответствующих различиям отдельных индивидов меж собой. Эта операция называется генотипированием, и может осуществляться, например, с помощью ДНК-микрочипов, способных дать информацию слету о сотках тысяч (до миллиона!) однонуклеотидных замен. Такие исследования пока существенно дешевле полного чтения ДНК индивидума, а большущее число исследуемых снипов позволяет рассчитывать, что найденные различия укажут на место в хромосоме, предположительно связанное с тем или другим заболеванием.
В базе масштабных генетических сканирований с анализом ассоциации (или сцепления) генов (Genome-wide association/linkage study) находится статистическая процедура, определяющая значимость различия того или другого снипа меж группами больных и здоровых людей. Аналогично простейшей математической статистике, происходит расчёт вероятности того, что генетическое отличие по определенной позиции случаем, и если эта возможность достаточно мала (например, меньше 10&��6), такую гипотезу отвергают. Другими словами, это будет означать, что данная замена (мутация) в геноме не случайна, другими словами как-то связана с заболеванием (по наличию которого, практически, и различаются сравниваемые группы пациентов). Когда учёные говорят (а позднее газетчики на собственных длинных языках разносят), что «такой-то ген связан с развитием заболевания такого-то», практически всегда речь идёт непосредственно о таком анализе.
Но вернёмся к витилиго. Большая международная команда учёных провела серию масштабных генетических сканирований, в конечном итоге которых были выделены несколько генов, предположительно связанных с риском развития этого заболевания [6, 7]. В одно из исследований вошли 1514 пациентов с витилиго и уже «готовые» публично доступные генотипы 2813 здоровых личностей («контроль»), а в другое — 647 больных и 1056 здоровых людей, прогенотипированных специально для этой работы. Во всех случаях генотипируемые были евро происхождения. Для исследования некоторых качеств в одном из исследований работа проводилась на мультиплексных семьях (в каких находятся несколько больных, состоящих в родстве). Для генов-«кандидатов», избранных по данным анализа генетической ассоциации, проверяли «репликацию» ассоциации, другими словами на 2-ух независимых выборках больные/здоровые заново выясняли, сохраняется ли найденная закономерность ассоциации определённого гена с риском развития витилиго. Результаты первого исследования [6] показаны на рисунке.
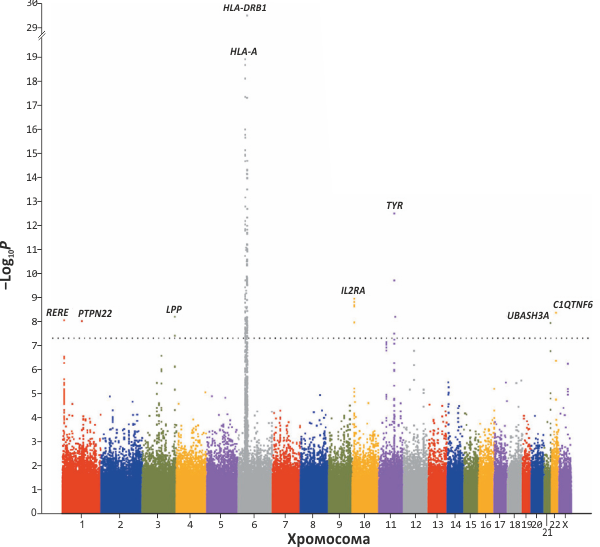
Полногеномное сканирование с анализом ассоциации генов. На рисунке приведены данные о генотипировании 520460 «снипов» (однонуклеотидных замен), раскрашенные по хромосоме, в какой они расположены. Ордината каждой точки соответствует отрицательному логарифму вероятности того, что отличие последовательности ДНК в этом снипе меж группой больных и здоровых — случайное. Проще говоря, чем «выше» находится точка, тем больше шанс того, что соответствующая замена связана с развитием заболевания. Пунктирная линия показывает порог, «выше» которого отличия считались необходимыми (P<5&規10&��8). Надписи обозначают наименования генов, к которым относятся такие замены:
RERE — ген повторяющегося дипептида аргинин/глутамат (RE), участвующего в генетической регуляции и в некоторых случаях запускающего апоптоз («запрограммированную» погибель клетки);
PTPN22 — ген лимфоидной тирозинфосфатазы, мутации в каком могут вызывать диабет первого типа, ревматоидный артрит, волчанку, диффузный токсический зоб;
HLA-A / HLA-DRB1 — гены белков головного комплекса гистосовместимости подтипов I и II, расположенные в 6-ой хромосоме. Эти белки отвечают за массу иммунных функций, а конкретно — за презентирование антигенов Т-лимфоцитам;
IL2RA — ген &豩-цепи детектора интерлейкина 2. Этот белок уничтожается трипаносомой при заболевания Шагаса, что вызывает хроническое ингибирование иммунитета;
TYR — ген тирозиназы, отвечающей за синтез меланина. Мутация в этом гене также может привести к альбинизму.
Что интересно, подавляющее большая часть генов, «уличённых» в связи с витилиго, уже увидены во отношениях с другими аутоиммунными заболеваниями (см. рисунок), и только ген тирозиназы (TYR), непосредственно участвующей в синтезе меланина, не имеет никакого дела к иммунной системе. Мутантная форма тирозиназы (R402&��Q402) практически перестаёт делать пигмент (что и приводит к появлению белых пятен), а заодно такой её вариант становится иммуногенным для собственного организма, — непосредственно мутантая тирозиназа является основным аутоантигеном при витилиго (и это «добивает» меланоциты). Но оказывается, что нет худа без добра: аллельная форма тирозиназы, соответственная для витилиго, оказалась исключающей по отношению к другому аллельному варианту, вызывающему меланому! (Другими словами — увеличивающийся риск витилиго, связанный с этой заменой, «автоматически» понижает возможность возникновения опухоли.)
2-ое исследование позволило добавить к уже найденным ещё пару «иммунных» генов, также связанную с развитием витилиго [7]. Ген FOXP1 кодирует транскрипционный фактор, играющий решающую роль в развитии B- и T-лимфоцитов, также моноцитов. Ген CCR6 кодирует мембранный хемокиновый детектор 6, распознающий воспалительный медиатор (хемокин) CCL20, выделяемый макрофагами.
Как видно из всего этого «винегрета», объяснить развитие заболевания каким-то одним фактором, по-видимому, принципиально нереально. Кстати, по оценкам исследователей, найденные ими мутации позволяют объяснить наименее 10% «генетического риска» возникновения заболевания. Развитие витилиго может начаться с разных «концов», но, с другой стороны, в предстоящем это позволит использовать различные типы исцеления и терапии, дополняющие друг друга.
«Витилиго — сложное и многофакторное болезнь, включающее не только генетику, ну и многочисленные предпосылки среды», — говорит Маргарет «Пегги» Уоллес (Margaret Wallace), доктор молекулярной генетики и микробиологии, член Института генетики и Центра эпигенетики во Флоридском институте и одна из ведущих создателей работы. — «Видимо, и для терапии существует неограниченное количество возможностей. Отлично изучив все „тропинки“, по которым может продвигаться витилиго, мы, в конце концов, научимся пресекать путь заболевания. Не считая того, очевидно, что это — неплохой вариант для персонализованной медицины будущего, когда исцеление можно будет подбирать с учётом личных генетических особенностей каждого пациента» [8].
Сначало статья расположена в журнале «Косметика & Медицина» [9].
Литература
1. биомолекула: «Геном человека: как это было и как это будет»;
2. биомолекула: «В полку генов убыло»;
3. биомолекула: «Геном человека: подходящая книга, или глянцевый журнал?»;
4. биомолекула: «„Мусорная“ ДНК управляет эволюцией млекопитающих?»;
5. биомолекула: «Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован»;
6. Jin Y., Birlea S.A., Fain P.R., Gowan K., Riccardi S.L., Holland P.J., Mailloux C.M., Sufit A.J., Hutton S.M., Amadi-Myers A., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Variant of TYR and autoimmunity susceptibility loci in generalized vitiligo. N. Engl. J. Med. 362, 1686–1697;
7. Jin Y., Birlea S.A., Fain P.R., Mailloux C.M., Riccardi S.L., Gowan K., Holland P.J., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Common variants in FOXP1 are associated with generalized vitiligo. Nat Genet. 42, 576–578;
8. ScienceDaily — «Scientists Begin to Unravel Causes of Mysterious Skin Disease»;
9. Чугунов А. О. Генетические тропинки «загадочной заболевания кожи» — витилиго. Косметика & медицина 3 (2010), 24–27
Чугунов Антон
Похожие статьи:
 Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то
Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то
 Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то, что оно имеет отношение к аутоиммунным процессам. Международный консорциум учёных провёл крупномасштабное генетическое сканирование, которое выявило несколько генов, с неправильной работой которых может быть связано развитие заболевания. Правда, это пока только 1-ый шаг — о лечении и даже о точных молекулярных и клеточных механизмах исследователи пока сказать ничего не могут.
Витилиго (от лат. vitiligo — накожная болезнь, лишай) — хроническое болезнь, выражающееся поначалу в появлении участков депигментированной кожи, волосяной покров в каких также становится седым. Это явление вызвано нарушением работы меланоцитов — клеток, производящих пигменты кожи (поначалу, меланин), — из-за их нефункциональности или даже просто погибели. Витилиго имеет аутоиммунную природу — другими словами, меланоциты гибнут из-за сбоя определения в системе клеточного иммунитета, когда свои собственные «тканевые стражи» (макрофаги, лимфоциты) начинают атаковать меланоциты и выводить их из строя. Витилиго часто сопровождается другими аутоиммунными заболеваниями, — например, тиреоидитом или системной красной волчанкой. Предварительные исследования показали, что генетические недочеты, вызывающие витилиго, в основном относятся к генам иммунной системы, также к генам самих меланоцитов.
Это болезнь, в общем-то, не опасно, но оно портит внешность человека. Широко известна история, когда поп-король Майкл Джексон, сначало темнокожий, умеренно превратился в «белого человека». Эта метаморфоза продолжительно обсасывалась бульварной прессой, но, по-видимому, перевоплощение было вызвано не расовыми убеждениями или чем-то более экстравагантным, а непосредственно витилиго, 1-ые признаки которого появились у певца поначалу 1980-х. Именитая белая перчатка с блёстками, ставшая объектом подражания многочисленных имитаторов, служила для сокрытия начинающейся заболевания, когда ладонь темнокожего артиста стала белеть. Позже, когда перчатка и грим окончили помогать, Джексон делал пластические операции для выравнивания общего оттенка кожи, — тогда, уже фактически белой. В диагнозе «короля» считается также и системная красная волчанка.
Есть не только заболевания, всерьёз угрожающие жизни, ну и заболевания, наносящие урон резвее стилю человека, нежели его здоровью. К числу таких недугов относится витилиго — «загадочная болезнь», при которой поверхность кожи покрывают белые (лишённые пигментации) пятна, со временем увеличивающиеся и сливающиеся меж собой.
О природе этого явления понятно очень мало, — в основном, только то, что оно имеет отношение к аутоиммунным процессам. Международный консорциум учёных провёл крупномасштабное генетическое сканирование, которое выявило несколько генов, с неправильной работой которых может быть связано развитие заболевания. Правда, это пока только 1-ый шаг — о лечении и даже о точных молекулярных и клеточных механизмах исследователи пока сказать ничего не могут.
Витилиго (от лат. vitiligo — накожная болезнь, лишай) — хроническое болезнь, выражающееся поначалу в появлении участков депигментированной кожи, волосяной покров в каких также становится седым. Это явление вызвано нарушением работы меланоцитов — клеток, производящих пигменты кожи (поначалу, меланин), — из-за их нефункциональности или даже просто погибели. Витилиго имеет аутоиммунную природу — другими словами, меланоциты гибнут из-за сбоя определения в системе клеточного иммунитета, когда свои собственные «тканевые стражи» (макрофаги, лимфоциты) начинают атаковать меланоциты и выводить их из строя. Витилиго часто сопровождается другими аутоиммунными заболеваниями, — например, тиреоидитом или системной красной волчанкой. Предварительные исследования показали, что генетические недочеты, вызывающие витилиго, в основном относятся к генам иммунной системы, также к генам самих меланоцитов.
Это болезнь, в общем-то, не опасно, но оно портит внешность человека. Широко известна история, когда поп-король Майкл Джексон, сначало темнокожий, умеренно превратился в «белого человека». Эта метаморфоза продолжительно обсасывалась бульварной прессой, но, по-видимому, перевоплощение было вызвано не расовыми убеждениями или чем-то более экстравагантным, а непосредственно витилиго, 1-ые признаки которого появились у певца поначалу 1980-х. Именитая белая перчатка с блёстками, ставшая объектом подражания многочисленных имитаторов, служила для сокрытия начинающейся заболевания, когда ладонь темнокожего артиста стала белеть. Позже, когда перчатка и грим окончили помогать, Джексон делал пластические операции для выравнивания общего оттенка кожи, — тогда, уже фактически белой. В диагнозе «короля» считается также и системная красная волчанка.
 Именитая белая перчатка с блёстками поп-короля Майкла Джексона — видимо, только попытка замаскировать прогрессирующее развитие витилиго. Картина: Википедия.
Исцеления витилиго не существует; есть только частичные меры, позволяющие замедлить развитие заболевания или уменьшить его внешние проявления. Поначалу, больным необходимо использовать сильные солнцезащитные крем&覙, потому что кожа, лишённая естественного фотофильтра, очень быстро сгорает на солнце, и в ней под действием ультрафиолетовых лучей даже может начать развиваться онкология. Вобщем, ультрафиолет диапазонов A и B употребляют и для терапии витилиго, но, естественно, в контролируемых клинических аспектах. Не считая обыденных косметических составов, только разглаживающих тон кожи, часто употребляют мази с кортикостероидами, которые в ряде различных случаев могут частично возвратить пигментацию. Не считая того, известны случаи удачной терапии кандаловём «подсаживания» в поражённую область «своих» меланоцитов с участка здоровой кожи, размноженных в искусственных аспектах. Не считая этого, есть данные об исцелении заболевания массой препаратов, обретенных из природных источников — чёрного перца, гинкго и даже человеческой плаценты, но эти результаты нельзя называть принятыми и широко распространёнными в мед и косметической практике.
Очевидно, что по-настоящему действующего способа исцеления не будет, пока не станут известны точные механизмы возникновения заболевания — другими словами, что непосредственно происходит на уровне отдельных клеток, когда уничтожаются свои собственные меланоциты, и что является предпосылкой этой «междоусобицы». В наш век постгеномных технологий [1] принято подходить к исследованию генетической подоплёки заболеваний достаточно формально — генотипируя большие группы пациентов с этой болезнью и сравнивая результаты с «контрольной» группой (состоящей из здоровых людей). При всем этом, чтобы ничего не упустить, недочеты ищут по всему геному, сравнивая отличия в сотках тысяч мест по всем хромосомам.
Примерный размер генома человека — три миллиардов пар оснований, но большая часть этого материала идентична не только для всех 2-ух людей, ну и, скажем, для человека и шимпанзе (или даже мыши). Основная масса различий кроется в так называемых однонуклеотидных заменах (или снипах — от SNP, single nucleotid polymorphism) — различиях в отдельных «буквах», составляющих «слово» (ген). При всем этом варианты 1-го гена, отличающиеся по одной (или нескольким) таким «буквам», будут называться аллельными.
Кстати, подавляющее количество снипов находится не в границах генов, кодирующих белки (которых всего-то чуть больше 20 тысяч [2]), а в «межгенных пространствах», составляющих основную массу ДНК. Роль этой «тёмной материи» ещё совсем не так издавна представлялась так непонятной, что эти области даже называли «мусорной ДНК» [3], но на сей день накопилась уже масса свидетельств тому, что этот «балласт» на самом деле делает принципиальные регуляторные функции. Кстати, может быть, что именно эта ДНК играет решающую роль в эволюции организмов и определяет отличие, например, меж человеком и остальными приматами [4].
Так или по другому, несмотря на медленное, но неотвратимое приближение эры «персональной геномики», когда каждый человек вместе со свидетельством о рождении будет получать и мед карту с полной последовательностью собственного генома [5], сейчас мед генетики сравнивают меж собой не целые геномы, а только наборы снипов, соответствующих различиям отдельных индивидов меж собой. Эта операция называется генотипированием, и может осуществляться, например, с помощью ДНК-микрочипов, способных дать информацию слету о сотках тысяч (до миллиона!) однонуклеотидных замен. Такие исследования пока существенно дешевле полного чтения ДНК индивидума, а большущее число исследуемых снипов позволяет рассчитывать, что найденные различия укажут на место в хромосоме, предположительно связанное с тем или другим заболеванием.
В базе масштабных генетических сканирований с анализом ассоциации (или сцепления) генов (Genome-wide association/linkage study) находится статистическая процедура, определяющая значимость различия того или другого снипа меж группами больных и здоровых людей. Аналогично простейшей математической статистике, происходит расчёт вероятности того, что генетическое отличие по определенной позиции случаем, и если эта возможность достаточно мала (например, меньше 10&��6), такую гипотезу отвергают. Другими словами, это будет означать, что данная замена (мутация) в геноме не случайна, другими словами как-то связана с заболеванием (по наличию которого, практически, и различаются сравниваемые группы пациентов). Когда учёные говорят (а позднее газетчики на собственных длинных языках разносят), что «такой-то ген связан с развитием заболевания такого-то», практически всегда речь идёт непосредственно о таком анализе.
Но вернёмся к витилиго. Большая международная команда учёных провела серию масштабных генетических сканирований, в конечном итоге которых были выделены несколько генов, предположительно связанных с риском развития этого заболевания [6, 7]. В одно из исследований вошли 1514 пациентов с витилиго и уже «готовые» публично доступные генотипы 2813 здоровых личностей («контроль»), а в другое — 647 больных и 1056 здоровых людей, прогенотипированных специально для этой работы. Во всех случаях генотипируемые были евро происхождения. Для исследования некоторых качеств в одном из исследований работа проводилась на мультиплексных семьях (в каких находятся несколько больных, состоящих в родстве). Для генов-«кандидатов», избранных по данным анализа генетической ассоциации, проверяли «репликацию» ассоциации, другими словами на 2-ух независимых выборках больные/здоровые заново выясняли, сохраняется ли найденная закономерность ассоциации определённого гена с риском развития витилиго. Результаты первого исследования [6] показаны на рисунке.
Именитая белая перчатка с блёстками поп-короля Майкла Джексона — видимо, только попытка замаскировать прогрессирующее развитие витилиго. Картина: Википедия.
Исцеления витилиго не существует; есть только частичные меры, позволяющие замедлить развитие заболевания или уменьшить его внешние проявления. Поначалу, больным необходимо использовать сильные солнцезащитные крем&覙, потому что кожа, лишённая естественного фотофильтра, очень быстро сгорает на солнце, и в ней под действием ультрафиолетовых лучей даже может начать развиваться онкология. Вобщем, ультрафиолет диапазонов A и B употребляют и для терапии витилиго, но, естественно, в контролируемых клинических аспектах. Не считая обыденных косметических составов, только разглаживающих тон кожи, часто употребляют мази с кортикостероидами, которые в ряде различных случаев могут частично возвратить пигментацию. Не считая того, известны случаи удачной терапии кандаловём «подсаживания» в поражённую область «своих» меланоцитов с участка здоровой кожи, размноженных в искусственных аспектах. Не считая этого, есть данные об исцелении заболевания массой препаратов, обретенных из природных источников — чёрного перца, гинкго и даже человеческой плаценты, но эти результаты нельзя называть принятыми и широко распространёнными в мед и косметической практике.
Очевидно, что по-настоящему действующего способа исцеления не будет, пока не станут известны точные механизмы возникновения заболевания — другими словами, что непосредственно происходит на уровне отдельных клеток, когда уничтожаются свои собственные меланоциты, и что является предпосылкой этой «междоусобицы». В наш век постгеномных технологий [1] принято подходить к исследованию генетической подоплёки заболеваний достаточно формально — генотипируя большие группы пациентов с этой болезнью и сравнивая результаты с «контрольной» группой (состоящей из здоровых людей). При всем этом, чтобы ничего не упустить, недочеты ищут по всему геному, сравнивая отличия в сотках тысяч мест по всем хромосомам.
Примерный размер генома человека — три миллиардов пар оснований, но большая часть этого материала идентична не только для всех 2-ух людей, ну и, скажем, для человека и шимпанзе (или даже мыши). Основная масса различий кроется в так называемых однонуклеотидных заменах (или снипах — от SNP, single nucleotid polymorphism) — различиях в отдельных «буквах», составляющих «слово» (ген). При всем этом варианты 1-го гена, отличающиеся по одной (или нескольким) таким «буквам», будут называться аллельными.
Кстати, подавляющее количество снипов находится не в границах генов, кодирующих белки (которых всего-то чуть больше 20 тысяч [2]), а в «межгенных пространствах», составляющих основную массу ДНК. Роль этой «тёмной материи» ещё совсем не так издавна представлялась так непонятной, что эти области даже называли «мусорной ДНК» [3], но на сей день накопилась уже масса свидетельств тому, что этот «балласт» на самом деле делает принципиальные регуляторные функции. Кстати, может быть, что именно эта ДНК играет решающую роль в эволюции организмов и определяет отличие, например, меж человеком и остальными приматами [4].
Так или по другому, несмотря на медленное, но неотвратимое приближение эры «персональной геномики», когда каждый человек вместе со свидетельством о рождении будет получать и мед карту с полной последовательностью собственного генома [5], сейчас мед генетики сравнивают меж собой не целые геномы, а только наборы снипов, соответствующих различиям отдельных индивидов меж собой. Эта операция называется генотипированием, и может осуществляться, например, с помощью ДНК-микрочипов, способных дать информацию слету о сотках тысяч (до миллиона!) однонуклеотидных замен. Такие исследования пока существенно дешевле полного чтения ДНК индивидума, а большущее число исследуемых снипов позволяет рассчитывать, что найденные различия укажут на место в хромосоме, предположительно связанное с тем или другим заболеванием.
В базе масштабных генетических сканирований с анализом ассоциации (или сцепления) генов (Genome-wide association/linkage study) находится статистическая процедура, определяющая значимость различия того или другого снипа меж группами больных и здоровых людей. Аналогично простейшей математической статистике, происходит расчёт вероятности того, что генетическое отличие по определенной позиции случаем, и если эта возможность достаточно мала (например, меньше 10&��6), такую гипотезу отвергают. Другими словами, это будет означать, что данная замена (мутация) в геноме не случайна, другими словами как-то связана с заболеванием (по наличию которого, практически, и различаются сравниваемые группы пациентов). Когда учёные говорят (а позднее газетчики на собственных длинных языках разносят), что «такой-то ген связан с развитием заболевания такого-то», практически всегда речь идёт непосредственно о таком анализе.
Но вернёмся к витилиго. Большая международная команда учёных провела серию масштабных генетических сканирований, в конечном итоге которых были выделены несколько генов, предположительно связанных с риском развития этого заболевания [6, 7]. В одно из исследований вошли 1514 пациентов с витилиго и уже «готовые» публично доступные генотипы 2813 здоровых личностей («контроль»), а в другое — 647 больных и 1056 здоровых людей, прогенотипированных специально для этой работы. Во всех случаях генотипируемые были евро происхождения. Для исследования некоторых качеств в одном из исследований работа проводилась на мультиплексных семьях (в каких находятся несколько больных, состоящих в родстве). Для генов-«кандидатов», избранных по данным анализа генетической ассоциации, проверяли «репликацию» ассоциации, другими словами на 2-ух независимых выборках больные/здоровые заново выясняли, сохраняется ли найденная закономерность ассоциации определённого гена с риском развития витилиго. Результаты первого исследования [6] показаны на рисунке.
 Полногеномное сканирование с анализом ассоциации генов. На рисунке приведены данные о генотипировании 520460 «снипов» (однонуклеотидных замен), раскрашенные по хромосоме, в какой они расположены. Ордината каждой точки соответствует отрицательному логарифму вероятности того, что отличие последовательности ДНК в этом снипе меж группой больных и здоровых — случайное. Проще говоря, чем «выше» находится точка, тем больше шанс того, что соответствующая замена связана с развитием заболевания. Пунктирная линия показывает порог, «выше» которого отличия считались необходимыми (P<5&規10&��8). Надписи обозначают наименования генов, к которым относятся такие замены:
RERE — ген повторяющегося дипептида аргинин/глутамат (RE), участвующего в генетической регуляции и в некоторых случаях запускающего апоптоз («запрограммированную» погибель клетки);
PTPN22 — ген лимфоидной тирозинфосфатазы, мутации в каком могут вызывать диабет первого типа, ревматоидный артрит, волчанку, диффузный токсический зоб;
HLA-A / HLA-DRB1 — гены белков головного комплекса гистосовместимости подтипов I и II, расположенные в 6-ой хромосоме. Эти белки отвечают за массу иммунных функций, а конкретно — за презентирование антигенов Т-лимфоцитам;
IL2RA — ген &豩-цепи детектора интерлейкина 2. Этот белок уничтожается трипаносомой при заболевания Шагаса, что вызывает хроническое ингибирование иммунитета;
TYR — ген тирозиназы, отвечающей за синтез меланина. Мутация в этом гене также может привести к альбинизму.
Что интересно, подавляющее большая часть генов, «уличённых» в связи с витилиго, уже увидены во отношениях с другими аутоиммунными заболеваниями (см. рисунок), и только ген тирозиназы (TYR), непосредственно участвующей в синтезе меланина, не имеет никакого дела к иммунной системе. Мутантная форма тирозиназы (R402&��Q402) практически перестаёт делать пигмент (что и приводит к появлению белых пятен), а заодно такой её вариант становится иммуногенным для собственного организма, — непосредственно мутантая тирозиназа является основным аутоантигеном при витилиго (и это «добивает» меланоциты). Но оказывается, что нет худа без добра: аллельная форма тирозиназы, соответственная для витилиго, оказалась исключающей по отношению к другому аллельному варианту, вызывающему меланому! (Другими словами — увеличивающийся риск витилиго, связанный с этой заменой, «автоматически» понижает возможность возникновения опухоли.)
2-ое исследование позволило добавить к уже найденным ещё пару «иммунных» генов, также связанную с развитием витилиго [7]. Ген FOXP1 кодирует транскрипционный фактор, играющий решающую роль в развитии B- и T-лимфоцитов, также моноцитов. Ген CCR6 кодирует мембранный хемокиновый детектор 6, распознающий воспалительный медиатор (хемокин) CCL20, выделяемый макрофагами.
Как видно из всего этого «винегрета», объяснить развитие заболевания каким-то одним фактором, по-видимому, принципиально нереально. Кстати, по оценкам исследователей, найденные ими мутации позволяют объяснить наименее 10% «генетического риска» возникновения заболевания. Развитие витилиго может начаться с разных «концов», но, с другой стороны, в предстоящем это позволит использовать различные типы исцеления и терапии, дополняющие друг друга.
«Витилиго — сложное и многофакторное болезнь, включающее не только генетику, ну и многочисленные предпосылки среды», — говорит Маргарет «Пегги» Уоллес (Margaret Wallace), доктор молекулярной генетики и микробиологии, член Института генетики и Центра эпигенетики во Флоридском институте и одна из ведущих создателей работы. — «Видимо, и для терапии существует неограниченное количество возможностей. Отлично изучив все „тропинки“, по которым может продвигаться витилиго, мы, в конце концов, научимся пресекать путь заболевания. Не считая того, очевидно, что это — неплохой вариант для персонализованной медицины будущего, когда исцеление можно будет подбирать с учётом личных генетических особенностей каждого пациента» [8].
Сначало статья расположена в журнале «Косметика & Медицина» [9].
Литература
1. биомолекула: «Геном человека: как это было и как это будет»;
2. биомолекула: «В полку генов убыло»;
3. биомолекула: «Геном человека: подходящая книга, или глянцевый журнал?»;
4. биомолекула: «„Мусорная“ ДНК управляет эволюцией млекопитающих?»;
5. биомолекула: «Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован»;
6. Jin Y., Birlea S.A., Fain P.R., Gowan K., Riccardi S.L., Holland P.J., Mailloux C.M., Sufit A.J., Hutton S.M., Amadi-Myers A., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Variant of TYR and autoimmunity susceptibility loci in generalized vitiligo. N. Engl. J. Med. 362, 1686–1697;
7. Jin Y., Birlea S.A., Fain P.R., Mailloux C.M., Riccardi S.L., Gowan K., Holland P.J., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Common variants in FOXP1 are associated with generalized vitiligo. Nat Genet. 42, 576–578;
8. ScienceDaily — «Scientists Begin to Unravel Causes of Mysterious Skin Disease»;
9. Чугунов А. О. Генетические тропинки «загадочной заболевания кожи» — витилиго. Косметика & медицина 3 (2010), 24–27
Чугунов Антон
Полногеномное сканирование с анализом ассоциации генов. На рисунке приведены данные о генотипировании 520460 «снипов» (однонуклеотидных замен), раскрашенные по хромосоме, в какой они расположены. Ордината каждой точки соответствует отрицательному логарифму вероятности того, что отличие последовательности ДНК в этом снипе меж группой больных и здоровых — случайное. Проще говоря, чем «выше» находится точка, тем больше шанс того, что соответствующая замена связана с развитием заболевания. Пунктирная линия показывает порог, «выше» которого отличия считались необходимыми (P<5&規10&��8). Надписи обозначают наименования генов, к которым относятся такие замены:
RERE — ген повторяющегося дипептида аргинин/глутамат (RE), участвующего в генетической регуляции и в некоторых случаях запускающего апоптоз («запрограммированную» погибель клетки);
PTPN22 — ген лимфоидной тирозинфосфатазы, мутации в каком могут вызывать диабет первого типа, ревматоидный артрит, волчанку, диффузный токсический зоб;
HLA-A / HLA-DRB1 — гены белков головного комплекса гистосовместимости подтипов I и II, расположенные в 6-ой хромосоме. Эти белки отвечают за массу иммунных функций, а конкретно — за презентирование антигенов Т-лимфоцитам;
IL2RA — ген &豩-цепи детектора интерлейкина 2. Этот белок уничтожается трипаносомой при заболевания Шагаса, что вызывает хроническое ингибирование иммунитета;
TYR — ген тирозиназы, отвечающей за синтез меланина. Мутация в этом гене также может привести к альбинизму.
Что интересно, подавляющее большая часть генов, «уличённых» в связи с витилиго, уже увидены во отношениях с другими аутоиммунными заболеваниями (см. рисунок), и только ген тирозиназы (TYR), непосредственно участвующей в синтезе меланина, не имеет никакого дела к иммунной системе. Мутантная форма тирозиназы (R402&��Q402) практически перестаёт делать пигмент (что и приводит к появлению белых пятен), а заодно такой её вариант становится иммуногенным для собственного организма, — непосредственно мутантая тирозиназа является основным аутоантигеном при витилиго (и это «добивает» меланоциты). Но оказывается, что нет худа без добра: аллельная форма тирозиназы, соответственная для витилиго, оказалась исключающей по отношению к другому аллельному варианту, вызывающему меланому! (Другими словами — увеличивающийся риск витилиго, связанный с этой заменой, «автоматически» понижает возможность возникновения опухоли.)
2-ое исследование позволило добавить к уже найденным ещё пару «иммунных» генов, также связанную с развитием витилиго [7]. Ген FOXP1 кодирует транскрипционный фактор, играющий решающую роль в развитии B- и T-лимфоцитов, также моноцитов. Ген CCR6 кодирует мембранный хемокиновый детектор 6, распознающий воспалительный медиатор (хемокин) CCL20, выделяемый макрофагами.
Как видно из всего этого «винегрета», объяснить развитие заболевания каким-то одним фактором, по-видимому, принципиально нереально. Кстати, по оценкам исследователей, найденные ими мутации позволяют объяснить наименее 10% «генетического риска» возникновения заболевания. Развитие витилиго может начаться с разных «концов», но, с другой стороны, в предстоящем это позволит использовать различные типы исцеления и терапии, дополняющие друг друга.
«Витилиго — сложное и многофакторное болезнь, включающее не только генетику, ну и многочисленные предпосылки среды», — говорит Маргарет «Пегги» Уоллес (Margaret Wallace), доктор молекулярной генетики и микробиологии, член Института генетики и Центра эпигенетики во Флоридском институте и одна из ведущих создателей работы. — «Видимо, и для терапии существует неограниченное количество возможностей. Отлично изучив все „тропинки“, по которым может продвигаться витилиго, мы, в конце концов, научимся пресекать путь заболевания. Не считая того, очевидно, что это — неплохой вариант для персонализованной медицины будущего, когда исцеление можно будет подбирать с учётом личных генетических особенностей каждого пациента» [8].
Сначало статья расположена в журнале «Косметика & Медицина» [9].
Литература
1. биомолекула: «Геном человека: как это было и как это будет»;
2. биомолекула: «В полку генов убыло»;
3. биомолекула: «Геном человека: подходящая книга, или глянцевый журнал?»;
4. биомолекула: «„Мусорная“ ДНК управляет эволюцией млекопитающих?»;
5. биомолекула: «Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован»;
6. Jin Y., Birlea S.A., Fain P.R., Gowan K., Riccardi S.L., Holland P.J., Mailloux C.M., Sufit A.J., Hutton S.M., Amadi-Myers A., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Variant of TYR and autoimmunity susceptibility loci in generalized vitiligo. N. Engl. J. Med. 362, 1686–1697;
7. Jin Y., Birlea S.A., Fain P.R., Mailloux C.M., Riccardi S.L., Gowan K., Holland P.J., Bennett D.C., Wallace M.R., McCormack W.T., Kemp E.H., Gawkrodger D.J., Weetman A.P., Picardo M., Leone G., Ta&覧eb A., Jouary T., Ezzedine K., van Geel N., Lambert J., Overbeck A., Spritz R.A. (2010). Common variants in FOXP1 are associated with generalized vitiligo. Nat Genet. 42, 576–578;
8. ScienceDaily — «Scientists Begin to Unravel Causes of Mysterious Skin Disease»;
9. Чугунов А. О. Генетические тропинки «загадочной заболевания кожи» — витилиго. Косметика & медицина 3 (2010), 24–27
Чугунов Антон


