|
«Закон» необратимости эволюции («закон Долло») был сформулирован еще в XIX веке и с тех пор многократно обсуждался биологами-теоретиками и философами. Такие обсуждения обычно остаются спекулятивными и опираются на общефилософские идеи и отдельные примеры из палеонтологии и сравнительной анатомии («некоторые наземные позвоночные вернулись в воду, но обратно в рыб не превратились — стало быть, эволюция необратима»). Между тем, данный вопрос важен для понимания такой базовой характеристики эволюции, как соотношение в ней «случайного», вызванного стечением обстоятельств (в том числе эволюционной историей организма), и «закономерного», диктуемого требованиями целесообразности (адаптивности). Если бы любое эволюционное изменение можно было легко обратить вспять, то естественный отбор — единственный фактор, придающий эволюционным изменениям «осмысленность» (адаптивную направленность), — смог бы быстро и эффективно оптимизировать строение организмов, «подгоняя» их к условиям среды, без всякой оглядки на их предшествующую эволюционную историю. Необратимость большинства эволюционных изменений, напротив, свидетельствовала бы о том, что эволюционная история организмов накладывает жесткие ограничения на возможности их дальнейшей эволюции. Между тем, реально оценить степень необратимости того или иного эволюционного события на практике весьма трудно.
Джозеф Торнтон (Joseph W. Thornton) из Орегонского университета и его коллеги на примере эволюции глюкокортикоидного рецептора позвоночных (ГР) наглядно продемонстрировали, как и почему эволюционные изменения, происходящие на уровне одной белковой молекулы, могут стать необратимыми. Исследователи использовали целый арсенал новейших методов. Начали они со сравнения аминокислотных последовательностей 60 разных рецепторов стероидных гормонов, имеющихся у современных организмов. Они реконструировали эволюционную историю ГР и восстановили аминокислотную последовательность этого белка, какой она была в важнейших узлах (точках ветвления) эволюционного древа позвоночных.
|
Выяснилось, что ключевые события в эволюции ГР произошли свыше 400 млн лет назад и были приурочены к отрезку между двумя узлами древа, соответствующими: 1) разделению предков хрящевых рыб и всех прочих челюстноротых позвоночных; 2) разделению линий лучеперых и лопастеперых рыб (предки последних по совместительству являются также и предками всех наземных позвоночных).
Восстановленные аминокислотные последовательности, соответствующие этим двум узлам, авторы назвали соответственно AncGR1 и AncGR2. Первый белок был у последнего общего предка всех челюстноротых (к челюстноротым относятся хрящевые рыбы, костные рыбы и их потомки — наземные позвоночные, они же тетраподы). Обладателем второго белка был последний общий предок всех костных рыб и тетрапод, который жил на 40 млн лет позже.
Затем авторы искусственно синтезировали гены ГР, которые должны были иметься у этих давно вымерших предков, и заставили их работать в культуре клеток китайского хомячка. Вместе с «воскрешенными» генами ГР в клетки была внедрена генетическая конструкция, содержащая заимствованный у светлячков ген фермента люциферазы (см.: reporter gene assays). Регуляторная область этого гена была сконструирована таким образом, чтобы синтез люциферазы зависел от активности ГР. В результате можно было по силе свечения оценивать эффективность реагирования ГР на те или иные стероидные гормоны. Пространственная структура «воскрешенных» ГР изучалась при помощи рентгеноструктурного анализа (см. X-ray crystallography).
Первая часть полученных результатов была опубликована два года назад в журнале Science (Ortlund et al., 2007. Crystal Structure of an Ancient Protein: Evolution by Conformational Epistasis // Science. V. 317. P. 1544–1548; полный текст — PDF, 410 Кб). Выяснилось, что белок AncGR1 представлял собой сравнительно слабо специализированный рецептор, который реагировал на широкий круг так называемых минералокортикоидов, в том числе альдостерон и деоксикортикостерон. Этот рецептор реагировал также и на кортизол, но значительно слабее. Белок AncGR2, напротив, был специализированным рецептором, избирательно реагирующим на кортизол (как и современные ГР человека и других наземных позвоночных).
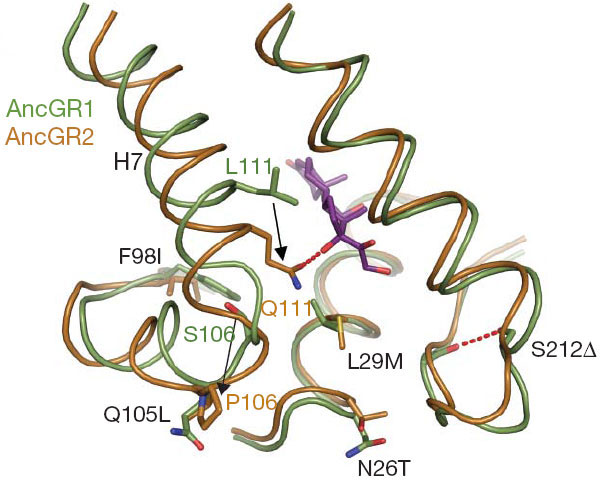
Смена функции рецептора при переходе от AncGR1 к AncGR2 была связана с заменой 37 аминокислот в той области белковой молекулы, которая отвечает за связывание стероидного гормона. Ученые выяснили, что ключевую роль в смене функции сыграли две из 37 замен (см. рисунок). Первая из них (замена серина (S) пролином (P) в позиции 106; обозначается S106P) изменила конфигурацию активного центра белковой молекулы таким образом, что аминокислота, находящаяся в 111-й позиции, оказалась рядом с уникальной гидроксильной группой кортизола, которая отсутствует у других стероидных гормонов. Вторая замена (L111Q) произошла как раз в 111-й позиции и привела к тому, что молекула кортизола стала прикрепляться к активному центру ГР дополнительной водородной связью. В дальнейшем произошли еще три замены, которые усилили новую функцию ГР (избирательное связывание кортизола), снизив его сродство к минералокортикоидам. Эти три замены, однако, снизили также и стабильность пространственной конфигурации белковой молекулы. Чтобы эти три замены смогли зафиксироваться, должны были произойти еще две замены, которые авторы назвали «разрешающими» (permissive) — в том смысле, что они сгладили вредные эффекты других замен и позволили им закрепиться в ходе естественного отбора.
Таким образом, для смены функции ГР в общей сложности понадобилось 7 аминокислотных замен — две «ключевые», три «оптимизирующие» и две «разрешающие». Авторы экспериментально показали, что если внести в белок AncGR1 соответствующие 7 изменений, белок приобретает новую функцию (то есть начинает избирательно связывать кортизол и перестает реагировать на минералокортикоиды). Такой белок (AncGR1 с семью заменами) функционирует почти так же, как AncGR2, который, как мы помним, отличается от AncGR1 не семью, а 37 заменами. Остальные 30 замен, по всей видимости, либо являются нейтральными (то есть зафиксировались случайно в результате генетического дрейфа), либо они способствовали оптимизации новой структуры и функции белка, но лишь в очень небольшой степени.
В новой работе, опубликованной в последнем номере журнала Nature, авторы показали, что некоторые из этих 30 «не очень нужных» замен, без которых белок ГР вполне мог бы обойтись, имели важный побочный эффект. Как выяснилось, они закрыли для белка возможность возврата к исходной функции, то есть сделали произошедшее ранее изменение эволюционно необратимым.
Естественный отбор не умеет заглядывать в будущее. Он не может зафиксировать вредную мутацию только потому, что она окажется полезной позже, когда зафиксируется следующая мутация. Поэтому возможны только такие эволюционные траектории, в которых каждый единичный шаг является либо полезным здесь и сейчас, либо, на худой конец, нейтральным. Пока новая функция ГР обеспечивалась только семью аминокислотными заменами, о которых говорилось выше (двумя «ключевыми», тремя «оптимизирующими» и двумя «разрешающими»), эволюция ГР еще могла повернуть вспять. Для этого было бы достаточно изменить направленность отбора. Допустим, древним позвоночным — предкам костных рыб и тетрапод — вдруг стало бы выгодно, чтобы их ГР снова начал реагировать на минералокортикоиды. В этом случае могли бы сначала вернуться в исходное состояние «оптимизирующие» мутации. Это привело бы к небольшому увеличению чувствительности ГР к минералокортикоидам, и поэтому такое изменение могло быть поддержано отбором. В дальнейшем можно было бы ожидать обращения вспять двух «ключевых» мутаций — это привело бы к полному восстановлению прежней функции.
Как мы уже знаем, если внести в белок AncGR1 семь мутаций, он меняет функцию: начинает избирательно реагировать на кортизол и перестает обращать внимание на минералокортикоиды. Понятно, что если вернуть эти семь аминокислот в исходное состояние, белок вернется к своей исходной функции. На этом этапе эволюция еще обратима. Однако когда авторы вернули в исходное состояние те же семь аминокислот в белке AncGR2, никакого возврата к прежней функции не произошло. Вместо этого получился абсолютно бесполезный белок, который не реагировал ни на кортизол, ни на минералокортикоиды. Причина, очевидно, кроется в тех 30 «дополнительных» мутациях, которые отличают AncGR2 от AncGR1.
Авторы провели всесторонний анализ этих 30 аминокислотных замен и пришли к выводу, что как минимум пять из них мешают возврату белковой молекулы к исходной пространственной конфигурации, необходимой для связывания минералокортикоидов. «Пользы» от этих замен, по-видимому, было не очень много: они лишь слегка повысили стабильность новой конфигурации, необходимой для связывания кортизола. Но они тем не менее зафиксировались, потому что естественный отбор «видит» только сиюминутную выгоду, пусть и небольшую, и не может заглянуть даже на шаг вперед. Таким образом, отрезание пути к отступлению — своеобразное эволюционное сжигание мостов — оказалось случайным побочным эффектом мелких, второстепенных эволюционных «работ» по оптимизации новой функции.
Возврат этих пяти мутаций в исходное состояние крайне маловероятен, потому что от такого возврата организм не получает никакой мгновенной выгоды: новая функция начинает выполняться чуть хуже, старая не восстанавливается. А пока эти пять мутаций не вернутся в исходное состояние, остается невозможной (= однозначно вредной) реверсия тех семи аминокислотных замен, которые обеспечили смену функции белка.
Сколько интересных возможностей было безвозвратно потеряно в ходе эволюции из-за «недальновидности» ее главного распорядителя — естественного отбора? Точного ответа на этот вопрос пока нет, но не исключено, что потерянных возможностей было гораздо больше, чем реализованных.