Исследования опубликованы в журналах Cell и Nature и дают предпосылки для новых методов лечения таких заболеваний крови, как лейкемия, иммунодефицит и серповидноклеточная анемия, предполагая новые пути создания кровяных клеток, в которых нуждаются пациенты. Это может помочь пациентам, которые испытывают необходимость в пересадке костного мозга или введении пуповинной крови, но не имеют подходящего донора.
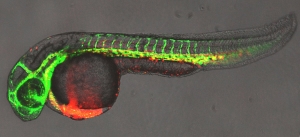
Группа, возглавляемая Леонардом Зоном (Leonard Zon), использовали рыб Danio rerio, так как их прозрачные эмбрионы позволяют непосредственно наблюдать за их развитием. Зон и его коллеги обнаружили, что компоненты, регулирующие кровообращение, сильно влияют на экспрессию главного регулятора формирования крови, называемого Runx1, который так же является определяющим маркером для стволовых клеток крови, которые дают начало всем типам клеток кровяной системы.
Ряд мутантных эмбрионов с недостаточным сердцебиением и пониженной циркуляцией крови проявляли несколько пониженное количество стволовых клеток крови, что подтверждает предыдущее наблюдение. Последующие работы показали, что оксид азота, продукция которого возрастает в присутствии кровообращения, является ключевым биохимическим регулятором: повышение уровня оксида азота восстанавливает продукцию стволовых клеток крови в мутантных эмбрионах рыб, в то время как ингибирование оксида азота приводит к уменьшению количества стволовых клеток.
Зон и его коллеги продемонстрировали, что производство оксида азота сопряжено с инициацией формирования стволовых клеток крови и у других видов позвоночных. Подавление продукции оксида азота у мышей, как генетическим, так и химическим способами, сходным образом уменьшает количество функционального Runx1, экспрессируемого стволовыми клетками крови.
«Похоже, что оксид азота является критическим сигналом для начала производства стволовых клеток крови», говорит Зон.
Вторая группа ученых, чья работа опубликована в Nature, была возглавлена Джорджем Далей (George Q. Daley), и Гуилермо Гарсия-Гардена (Guillermo Garc?a-Carde?a). Заинтригованные появлением предшественников крови в стенке развивающейся аорты почти сразу же после начала сердцебиения, они начали исследовать эффект механической стимуляции на формирование крови в культивируемых эмбриональных стволовых клетках мышей.
Они показали, что напряжение сдвига – действие силы трения, создаваемой потоком жидкости по поверхности клеток, выстилающих аорту – повышает экспрессию основных регуляторов формирования крови, включая Runx1, и генетических маркеров, найденных у стволовых клеток крови. Напряжение сдвига так же повышает уровень формирования колоний клеток-предшественников, которые дают начало специфическим линиям дифференцировки кровяных клеток (эритроцитов, лейкоцитов и т.д.). Это открытие показало, что биомеханические силы способствуют формированию крови.
Далей, Гарсия-Гардена и их коллеги так же изучали мышиные эмбрионы с мутацией, предотвращающей инициацию сердцебиения. У таких эмбрионов было сильно снижено количество колоний предшественников кровяных клеток, наряду с уменьшением экспрессии генетических маркеров стволовых клеток крови. Однако когда такие специфические клетки мутантных эмбрионов были подвержены действию напряжения сдвига, уровень маркеров стволовых клеток крови и количество колоний кровяных клеток восстановились.
Исследователи так же показали, что при ингибировании продукции оксида азота, эффект действия напряжения сдвига на формирование колоний кровяных предшественников подавляется, как в клеточных культурах, так и в живых мышиных эмбрионах.
«При изучении того, как сердцебиение стимулирует формирование крови в эмбрионах, мы совершили большой шаг к пониманию того, каким образом можно управлять формированием крови из эмбриональных стволовых клеток в чашках Петри», говорит Далей.
«Данные наблюдения вскрывают неожиданную роль биомеханических сил в развитии эмбрионов», добавляет Гарсия-Гардена. «Наша работа подчеркивает критическую связь между формированием сердечнососудистой и гематопоэтической системами».
Авторы обеих работ спекулируют на тему того, что препараты, имитирующие эффект эмбрионального кровообращения на клетках-предшественниках крови, или молекулы, участвующие в сигнальной системе оксида азота, могут стать терапевтически полезными для пациентов с заболеваниями крови. Например, оксид азота может быть использован для выращивания и распространения стволовых клеток крови как в культуральной посуде, так и у пациентов после трансплантации.


