|
В цитоплазме клетки плавает множество белков, и их состав постоянно обновляется — с рибосом сходят «новорожденные» белки, а «состарившиеся», поврежденные и неверно сложенные подвергаются расщеплению (о том, как складываются белки, см.: Помогать науке можно играя, «Элементы», 01.09.2010; о том, какой вред могут нанести клетке неверно сложенные белки, см.: Нейрофибриллярные клубки при болезни Альцгеймера — не убийцы, а защитники клеток?, «Элементы», 15.05.2010).
Уничтожение «неугодных» белков происходит двумя путями. Во-первых, белок может быть проглочен лизосомой (она уничтожает белки не очень избирательно; кроме того, лизосомы — это всё-таки органеллы, они слишком крупные, чтобы встречаться в каждом клеточном «закоулке» и обеспечивать повсеместную потребность клетки в деградации белков). Во-вторых, белок может быть пойман протеасомой (см. также Proteasome), о чём мы сейчас и поговорим.
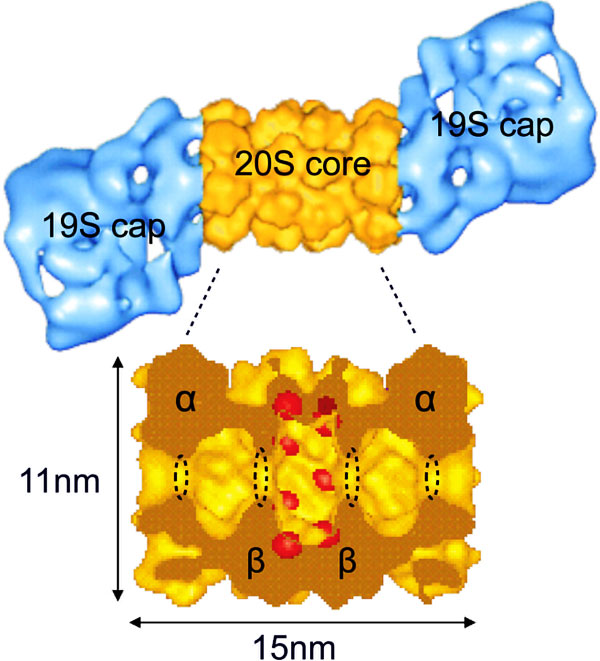
Протеасома — гигантский (с молекулярной массой около 2000 килодальтон) белковый комплекс. Классическая протеасома состоит из одной центральной частицы (ее коэффициент седиментации — см. седиментационный анализ — составляет 20S, и так — 20S — ее обычно и называют), в которой происходит расщепление белка, и двух регуляторных (19S), расположенных от нее с двух сторон. 19S-частицы распознают субстрат и отправляют его «в пасть» 20S.
Протеасома не занимается разбоем и не уничтожает первые встречные белки. Ее жертвы должны быть помечены «черной меткой» — цепочкой из не менее четырех маленьких белков убиквитинов (кстати, появляются данные о том, что роль убиквитина не всегда столь «убийственна», см. статью «Вездесущий убиквитин»). «Пришивание» убиквитина к обреченному белку происходит в несколько стадий с помощью трех видов ферментов. Именно убиквитиновую цепочку и распознают 19S-частицы, после чего отправляют «смертника» «на эшафот».
|
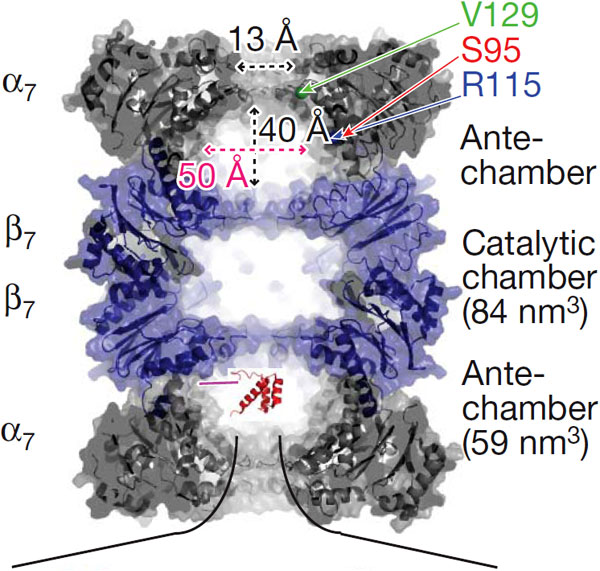
20S-частицы состоят из четырех сложенных в стопку колец, каждое из которых, в свою очередь, образовано семью субъединицами. Каждое наружное кольцо образовано семью альфа-субъединицами (?7); они служат местом прикрепления для 19S-частиц и «дверью», в которую входит обреченный белок. Каждое внутреннее кольцо образовано семью бета-субъединицами (?7), и именно в них и происходит расщепление белков. В 20S-частице есть три полости — одна центральная, каталитическая, в которой расщепляются белки, и два «преддверия», где белки томятся перед тем, как «взойти на эшафот».
Простая логика подсказывает, что, прежде чем разрезать на куски запутанную белковую цепочку, ее надо распутать, хотя бы частично. Очевидно, белки начинают разворачиваться в 19S-частице протеасомы, потому что у 20S-частицы отверстие очень узкое, всего 13 A, и свернутый белок в него просто не пролезет. Но вот что происходит с белком в «преддверии» и в каком он там находится состоянии, пока что не было достоверно известно."
Группа исследователей из Университета Торонто (Канада) и Института биохимии Макса Планка (Германия) высказала разумное предположение, что разворачивание белковой цепочки происходит в «преддверных» полостях 20S-частицы. Чтобы доказать это (а заодно изучить, что же происходит с белком там, внутри) они провели серию экспериментов с использованием ЯМР-спектроскопии (см. NMR spectroscopy, а также ядерный магнитный резонанс).
Чтобы изучить работу преддверной полости более подробно и выпукло, исследователи взяли для экспериментов сразу три белка, как можно более непохожие друг на друга по типу складывания, заряду и т. д. Белки эти (если быть точным, это были не целые белки, а только белковые фрагменты, с которыми просто удобней было работать) назывались EnHD, FynSH3 и Pin1WW. Все они, будучи оставленными в растворе наедине с 20S-субъединицей, легко подвергались расщеплению.
Основная часть исследований проводилась не на целом комплексе (его размер уже накладывает ограничения у метода спектроскопии — например, невозможно становится работать в большом диапазоне температур), а на двух ?7 кольцах, которые спонтанно соединяются в растворе, если там нет ?7 колец. В ?7?7 возникает примерно такая же полость, как и преддверная, а работать с ним гораздо легче. К тому же, самые важные результаты исследователи подтвердили на целом ?7?7?7?7-комплексе.
На той поверхности ?7-кольца, которая обращена в сторону полости, ученые выбрали три точки, к которым «пришивали» N-конец белка (эти точки на рисунке указаны как V129, S95 и R115). «Родная» аминокислота в каждом из этих участков была заменена на цистеин, к которому с помощью специального реагента можно было теперь пришивать белковую цепочку. Белок оставался связанным с полостью до тех пор, пока в раствор не добавляли высвобождающий его агент.
Спектры белков, находящихся внутри полости, были совершенно не похожи на спектры этих белков, когда они, правильно сложенные, свободно плавали в растворе. Скорее они напоминали спектры белков в денатурированном (то есть полностью развернутом) состоянии. А это означает, что наша полость — это и есть то место, где белки «разматываются» до аминокислотной цепочки.
Стоит отметить, что к какому бы из трех возможных мест внутри полости мы ни прикрепляли наши белки, их спектры менялись очень мало, что говорит о том, что конкретное местоположение белка в полости не имеет большого значения — где бы он ни оказался, он всё равно будет развернут.
Теперь предстояло узнать, меняется ли сама полость (и если меняется, то насколько), когда в нее попадает субстрат. Оказалось, что изменения эти незначительны: комплекс разворачивает белки, практически «не двигаясь», без помощи энергичных конформационных перестроек.
Еще один интересный момент — то, что при разных температурах комплекс работал по-разному. Один из трех наших белков — EnHD — разворачивался в полости даже при 25°С, остальные же при этой температуре пребывали в состоянии, близком к свернутому, а развернуться могли только при более высокой температуре. Видимо, это связано с тем, насколько трудно распутать ту или иную структуру — EnHD, например, свернут в альфа-спираль, а FynSH3 и Pin1WW имеют бета-конформацию.
Итак, какие же выводы мы можем сделать из полученных данных? Судя по всему, дело обстоит так. Белок (состоящий из множества аминокислот, каждая из которых обладает какими-либо свойствами — гидрофильностью, гидрофобностью, электрическим зарядом) попадает в полость преддверия протеасомы. Полость эта тоже выстлана разнообразными аминокислотами и группами аминокислот, которые притягивают соответствующие аминокислоты белка (например, положительно заряженные притягивают отрицательно заряженные, и наоборот). В результате белок растягивается, теряет свою первоначальную конформацию и разворачивается в цепочку. И эта развернутая цепочка отправляется в центральную каталитическую полость протеасомы, где будет разрезана на куски.