Эксперименты с вирусами Ф2 и их жертвами, бактериями Pseudomonas fluorescens, подтвердили классические представления, согласно которым эволюционная «гонка вооружений» резко ускоряет накопление генетических различий и способствует дивергенции (расхождению) эволюционирующих линий. Вирусы, вынужденные приспосабливаться к эволюции своих жертв, накапливали мутации быстрее и становились более разнообразными по сравнению с теми вирусами, которым исследователи позволили из поколения в поколение паразитировать на генетически идентичных (не эволюционирующих) бактериях.
Эволюционные «гонки вооружений» (evolutionary arms race), по-видимому, являются одним из самых мощных двигателей эволюции. Если бы среда обитания организмов оставалась строго постоянной, естественный отбор, скорее всего, привел бы их строение и физиологию к некому локальному оптимуму, после чего эволюционные изменения должны были бы замедлиться или вовсе прекратиться. Но среда обитания не может быть абсолютно неизменной хотя бы потому, что для большинства живых существ важнейшие параметры среды зависят от других живых организмов. Эволюция постоянно подстегивается положительными обратными связями, потому что изменения одних организмов меняют среду для других и вынуждают их приспосабливаться к этим изменениям, что, в свою очередь, опять меняет среду, и так далее, до бесконечности. «Гонка вооружений» может идти как между разными видами (например, когда газели и гепарды «соревнуются» друг с другом в скорости бега), так и внутри вида (той же газели, чтобы выжить, не так важно обогнать гепарда, как хотя бы одну другую газель), или, например, между самцами и самками (см.: П. Н. Петров. Самцы жуков-плавунцов насильники и убийцы; Sexual conflict).
Эти соображения легли в основу широко известной «гипотезы Черной королевы» (Red Queen’s hypothesis), о которой мы рассказывали в заметке Современные паразиты опаснее прошлых и будущих («Элементы», 12.12.2007). Согласно этой гипотезе, организмам приходится постоянно эволюционировать, чтобы сохранить свою приспособленность (эффективность размножения) на прежнем уровне («бежать со всех ног, чтобы остаться на месте»).
Всё это кажется достаточно простым и очевидным, но получить прямое экспериментальное подтверждение этих моделей не так-то просто, потому что эволюция, как известно, процесс медленный. Впрочем, биологи уже наловчились ставить красивые эксперименты по «эволюции в пробирке», используя для этого модельные объекты с быстрой сменой поколений, такие как бактерии, вирусы, дрожжи, насекомые или круглые черви.
В новой статье, опубликованной на сайте журнала Nature, британские биологи сообщили о новом экспериментальном подтверждении теоретических представлений, согласно которым антагонистическая сопряженная эволюция паразитов и их хозяев ускоряет эволюционные изменения и способствует росту генетического разнообразия (что, в свою очередь, является важнейшей предпосылкой для видообразования). В качестве модельной системы «паразит–хозяин» использовали бактерию Pseudomonas fluorescens и вирус-бактериофаг Ф2. С этой системой удобно работать, потому что вирусов и зараженных ими бактерий можно в любой момент разделить: бактерий можно «вылечить» от вирусов при помощи специальных химических препаратов, не вредящих здоровью бактерии, а вирусные частицы в чистом виде могут быть выделены из культуры путем центрифугирования.
Ранее авторы уже установили, что в этой системе действительно происходит эволюционная гонка вооружений: вирусы вырабатывают новые адаптации для заражения бактерий, а бактерии — новые средства защиты (Brockhurst et al. Experimental coevolution with bacteria and phage: the Pseudomonas fluorescens–Ф2 model system // Infect. Genet. Evol. 2007. V. 7. P. 547–552). До сих пор эти изменения анализировались только на уровне фенотипа (по способности вирусов заражать тех или иных бактерий и по способности бактерий защищаться). Оставались неизвестными молекулярные механизмы адаптации и скорость изменений на уровне ДНК (скорость молекулярной эволюции).
В эксперименте использовались бактерии, которые изначально были генетически идентичными, и исходно одинаковые вирусы. Всего было создано 12 подопытных популяций, каждая из которых изначально содержала 10 млн бактерий и 10 тыс. вирусных частиц. Популяции разделили на две группы (по шесть популяций в каждой), получившие условные названия «эволюция» (E) и «коэволюция» (C).
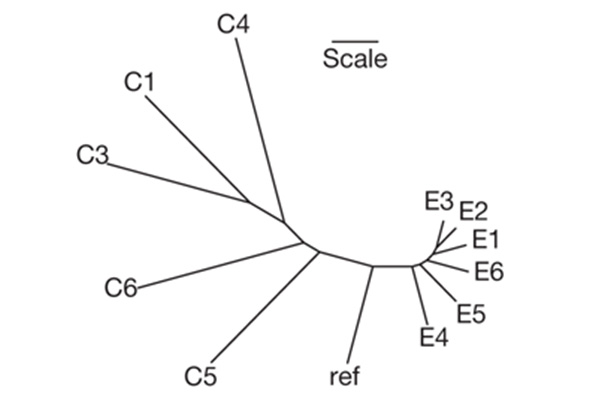
В популяциях группы E было позволено эволюционировать только вирусам, а бактерий при каждом переносе культуры в свежую питательную среду (это делалось раз в двое суток) заменяли исходными, «наивными» микробами. В группе C экспериментаторы позволяли эволюционировать как вирусам, так и их жертвам. Эволюционный эксперимент продолжался 24 дня. После этого были отсеквенированы (прочтены) геномы вирусов в каждой из 12 подопытных популяций. Эти геномы затем сравнивались с геномом исходного вируса и между собой. Геномы бактерий не секвенировали (они примерно в 100 раз больше, чем у фагов).
Оказалось, что у вирусов из группы C в ходе эксперимента закрепилось вдвое больше мутаций (в среднем по 23 мутации), чем у их коллег из группы E (в среднем 11 мутаций). Чем «появление» мутации отличается от ее «закрепления», см. в заметке Подведены итоги эволюционного эксперимента длиной в 40 000 поколений («Элементы», 02.11.2009). Таким образом, антагонистическая коэволюция действительно ускоряет накопление изменений на уровне ДНК (молекулярную эволюцию).
Популяции из группы C не только накопили больше отличий от исходного вируса. Они и друг от друга стали отличаться намного сильнее, чем популяции из группы E. Иными словами, вирусы из группы C значительно ближе подошли к превращению в шесть разных вирусов. Это значит, что антагонистическая коэволюция, по-видимому, действительно способствует генетической дивергенции и, в конечном счете, видообразованию.
Соответствует ли генетическая дивергенция фагов из шести популяций группы C дивергенции по фенотипу, то есть по способности заражать тех или иных бактерий? В поисках ответа авторы пытались заразить этими вирусами каждую из шести популяций бактерий, коэволюционировавших вместе с вирусами, и подсчитывали число «удачных» заражений. Оказалось, что шесть вирусных популяций различаются по своей способности заражать тех или иных бактерий, то есть имеют разные «спектры инфекционности». При этом чем выше генетическое сходство вирусов, тем более сходны и их спектры инфекционности. Характерно, что ни один из вирусов группы E не смог заразить ни одну из шести популяций бактерий из группы C. Получается, что за 24 дня эксперимента бактерии сильно продвинулись в выработке средств защиты от подобных вирусов, и те паразиты, которые не эволюционировали вместе с ними, безнадежно отстали от них в эволюционной гонке.
|
Авторы также заметили, что все вирусные гены, в которых вирусы из группы C накопили больше мутаций, чем вирусы из группы E (таких генов было выявлено четыре), участвуют в прикреплении фага к бактериальной клетке. От успешности этой процедуры зависит, сумеет ли фаг заразить бактерию. По-видимому, именно эти четыре гена являются для вирусов теми «вооружениями», на которые они делают ставку в «гонке».
Еще один интересный результат состоит в том, что в шести популяциях группы E многие эволюционные изменения оказались одинаковыми, то есть под действием одинаковых факторов отбора в разных популяциях закрепились одни и те же мутации. В популяциях группы C доля таких параллелизмов была ниже (см.: Пути эволюции предопределены на молекулярном уровне, «Элементы», 12.04.2006).
Данная работа интересна прежде всего как хороший пример прямого экспериментального подтверждения теоретических моделей, давно уже ставших общепринятыми, но до сих пор опиравшихся в основном на косвенные данные.