|
Группе ученых из Арканзасского медицинского университета (Литтл-Рок, США) под руководством Роберта Шмуклера Райса удалось достичь десятикратного — рекордного на сегодняшний день — увеличения продолжительности жизни червя нематоды. За счет всего одного изменения гена age-1 им удалось получить особей, которые давали долгоживущее, устойчивое к различным ядам, но при этом совершенно стерильное потомство.
Нематода (круглый червь) Caenorhabditis elegans — излюбленный модельный организм биологов. Если на примере бактерии E. coli биологи исследуют прокариот, на примере дрожжей Saccharomyces cerevisiae — одноклеточные организмы, то C. elegans, наряду с мушкой дрозофилой и лабораторной мышью, — незаменимый объект для исследования многоклеточных животных.
Любовь биологов к червю отчасти вызвана его прозрачностью и быстротой размножения (полный цикл развития C. elegans составляет около трех суток). И хотя C. elegans едва различим человеческим глазом (он достигает в длину лишь 1 мм), за несколько десятилетий исследований, часть которых посвящена проблемам старения организмов, этот крошечный червь принес уже немало пользы человечеству — с ним работали и продолжают работать молекулярные биологи, эмбриологи и даже нейробиологи (червь имеет нервную систему из трехсот нейронов).На сегодняшний день у C. elegans известно порядка 80 мутаций, влияющих на продолжительность жизни. В частности, ранее было замечено, что нарушения молекулярных каскадов, связанных с важным гормоном (присутствующим и у человека) — инсулиноподобным фактором роста
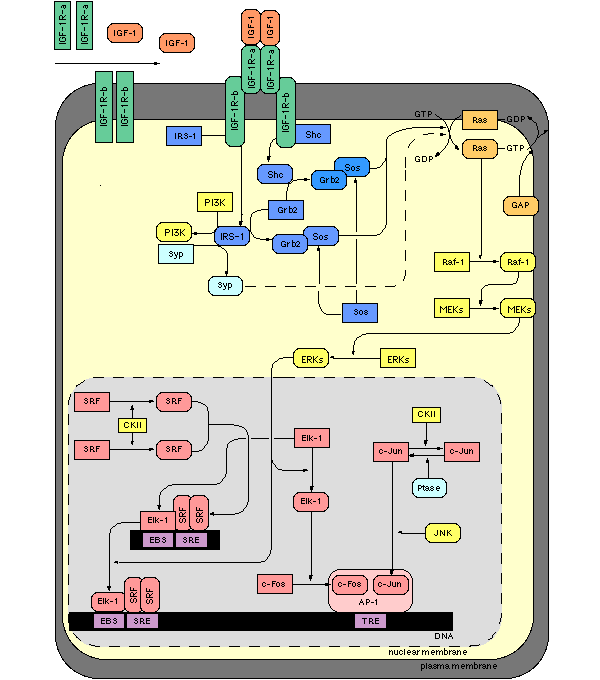
В любом организме — даже одноклеточном — есть целый ряд молекулярных каскадов, призванных передавать информацию о внешних воздействиях или изменениях внутренней среды к сложному механизму регуляции экспрессии генов. Пришедший на рецепторы клеточной мембраны сигнал (например, если молекула рецептора провзаимодействовала с сигнальной молекулой гормона, нейромедиатора или лекарства) запускает цепочку из сложных превращений, таких как изменение конформаций белков, добавление и удаление фосфатных групп, катализ и ингибирование различных биохимических реакций). На каждой стадии превращения происходит как усиление сигнала, так и передача его в необходимую сторону — к ядру и транскрипционным факторам, регулирующим транскрипцию ДНК с тех или иных генов.
|
К веществам, способным запускать молекулярные каскады, относятся, в частности, инсулин и инсулиноподобный фактор роста
ИФР-1 . Разветвленность молекулярных каскадов, запускаемых рецепторами инсулина, приводит к тому, что этот сравнительно короткий (51 аминокислота) пептид влияет на процессы от метаболизма глюкозы и регуляции кровяного давления до возникновения нейродегенеративных болезней. А схожая по молекулярной структуре цепочка из 70 аминокислот —
ИФР-1 — уже играет другую роль. Инсулиноподобный фактор роста участвует в процессах дифференцировки и роста клеток и даже может приводить к блокированию апоптоза — запрограммированной клеточной смерти.
ИФР-1 также участвует в регуляции синтеза соматотропного гормона (который у человека, уже на уровне организма в целом, отвечает за рост костей у детей и подростков), попутно влияя на синтез и распад белка и опять-таки уровень глюкозы в крови.
Сигнальный каскад, запускаемый инсулиноподобным фактором роста, весьма сложен. ИФР-1 сначала взаимодействует со специальными рецепторами, потом сигнал передается с участием фермента фосфатидилинозитол-3-киназы первого класса (PI3KCS) к четырем различным белкам-киназам и уже от киназ — к ядру и геному (где запускается или останавливается экспрессия генов). Вмешаться в работу этого каскада можно на разных этапах, отключая те или иные гены, и такие вмешательства нередко приводят к изменению продолжительности жизни червя.
В работе американских ученых изучалась нонсенс-мутация (приводящая к прерыванию синтеза белка: вместо кодона, кодирующего очередную аминокислоту в цепочке, появляется стоп-кодон) гена age-1, кодирующего белок PI3KCS. Ранее нарушение других звеньев сигнальной цепи изучалось на мутациях других генов — например, гена daf-2 (кодирующего рецептор
Райсу и коллегам удалось получить потомство от мутантов по гену age-1, которые до этого считались принципиально не достигающими зрелого возраста. Родители мутантных нематод были гетерозиготные — с работоспособной копией гена и за счет этого с нормальной физиологией. То есть в их диплоидных клетках только один комплект хромосом нес интересующую нас мутацию по гену age-1. Эффект от этой мутации проявился лишь у 1/4 потомства, которое (в полном соответствии с менделевскими законами наследования) получило оба комплекта генетического материала с мутацией по гену age-1. Эта четверть гомозиготных мутантов первого поколения несла какое-то количество материнского фермента и за счет этого была способна приносить потомство (без PI3K процесс формирования половых клеток не завершается). Мутантов удалось вырастить при пониженной температуре (15-20°C вместо нормальных 25°C, при которых, как показал ранее ряд авторов, происходила остановка развития на личиночной стадии) и получить уже второе поколение — интересное тем, что у них не было унаследованного с материнской яйцеклеткой фермента PI3KCS; в строгом понимании, именно эти нематоды испытали все эффекты мутации.
Гомозиготные мутанты второго поколения прожили в десять раз дольше, чем обычные C. elegans. Но при этом они были стерильны: полное отсутствие PI3KCS, в том числе и родительской, привело не только к удлинению жизни, но и к бесплодию. Так что отключение имеющегося молекулярного каскада (именно отключение существующих, а не добавление каких-то новых генов!) все-таки для них даром не прошло.
Возникает естественный вопрос: можно ли в принципе распространить результаты исследования на млекопитающих? Ведь мыши с мутациями, затрагивающими каскад ИФР-1, тоже жили дольше обычных, правда только в 1,7 раза и при этом для них были введены еще и дополнительные ограничения в питании. Так, может быть, возможно как-то компенсировать связанное с геном age-1 бесплодие и оставить только долгую жизнь?
Ряд данных указывает на то, что нельзя — по крайней мере, в одно действие. ИФР-1 и связанные с ним ферменты задействованы, как минимум, еще и в процессах метаболизма (подробное исследование тот же коллектив авторов обещает опубликовать в ближайшее время). Кроме того, черви-долгожители еще и оказались более стойкими к действию перекиси водорода, но менее стойкими к высоким температурам (35°C) по сравнению с обычными червями. Если один ген влияет на такое многообразие процессов, то что уж говорить о взаимодействии нескольких генов применительно к вызреванию яйцеклеток?