|
Трудно недооценить исследования, посвященные проблеме возникновения резистентности бактерий к антибиотикам. Сейчас производство новых антибиотиков напоминает соревнование на скорость: кто быстрее — бактерии или ученые-фармацевты. Ученые разрабатывают новые антибиотики, а бактерии учатся им противостоять. Короткий период этого забега используют пациенты, нуждающиеся в этом антибиотике. Чем длиннее забег, тем больше счастливых пациентов. Но время соревнования всё укорачивается, а в итоге всегда побеждают бактерии.
Как бактериям удается всё время побеждать? Все мы слышали о быстром появлении мутантных клеток, их предпочтительном выживании, быстром росте и дальнейшем успешном паразитировании мутантов даже в условиях высоких доз антибиотика. Трое американских ученых из Института Висса при Гарвардском университете, Медицинского института Говарда Хьюза и Бостонского университета пришли к выводу, что бактерии используют еще один путь для выработки резистентности — возможно, даже более эффективный. Если классическая схема предполагает выборочную элиминацию менее приспособленных клеток, то в обновленном варианте всё наоборот: в популяции приспособленные мутанты поддерживают неприспособленных соседей, за это те поддерживают высокие скорости роста всей колонии. Мы видим прекрасный модельный пример эволюционного возникновения альтруизма: некоторые бактерии затрачивают свои ресурсы на благо «общества», за счет чего всё общество выживает.
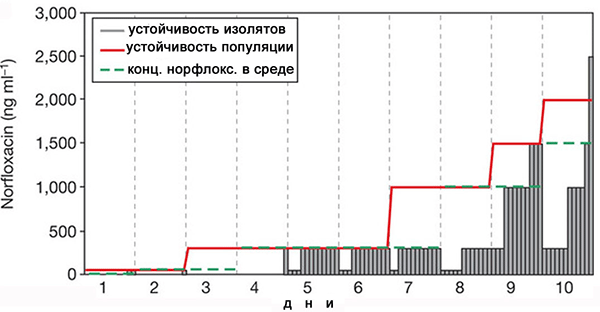
Этот альтруистический путь приспособления бактерий к антибиотику был доказан экспериментально с использованием клеток Escherichia coli, выращенных при увеличивающихся дозах антибиотика норфлоксацина. Опыт проводился так. Клетки растили на среде при концентрации норфлоксацина, убивающей около 2/3 популяции. Каждый день концентрация норфлоксацина корректировалась, чтобы этот показатель — 2/3 ингибирования — оставался стабильным. Каждый день из каждой пробы отбирались 12 случайных клеток и измерялась концентрация антибиотика, необходимая для подавления роста этих выделенных изолятов. Очевидно, что должен быть какой-то разброс в концентрации антибиотика — но какой именно? Результат оказался неожиданным.
|
Мы видим на рисунке, что красная линия, соответствующая всей популяции бактерий, существенно выше, чем у отдельных клеток. Это означает, что вся популяция клеток гораздо лучше переносит присутствие антибиотика, чем каждая клетка по отдельности. При этом на 9–10-й день зарегистрированы клетки, резистентность которых выше среднего уровня. Получается, что приспособившиеся клетки не только не конкурируют, а даже наоборот — помогают соседям перенести высокие концентрации норфлоксацина.
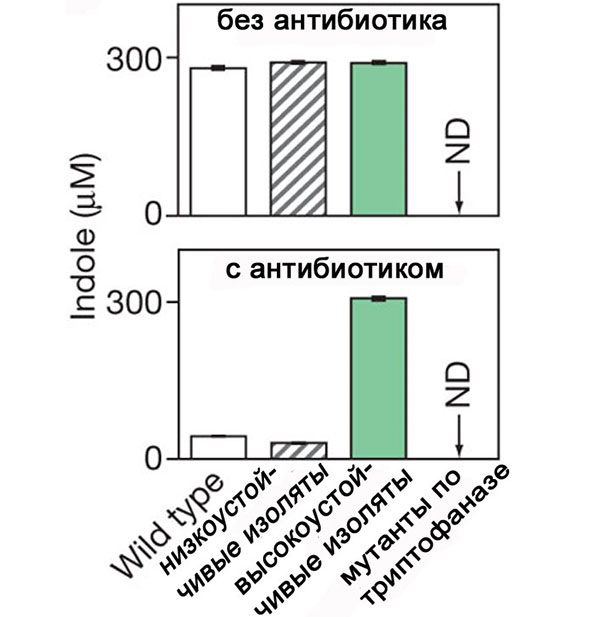
Ученые постарались выяснить биохимический и генетический механизм приспособления отдельных клеток и всей популяции E. coli. С помощью хроматографии определили, что у слаборезистентных клеток отсутствует фермент триптофаназа, который необходим для превращения аминокислоты триптофана в индол; у высокорезистентных клеток триптофаназа вырабатывалась. Именно индол обеспечивал высокую устойчивость клеток в условиях лекарственного стресса: добавив в среду чистый индол, ученые получали высокую устойчивость у низкорезистентной колонии. Высокую концентрацию индола в среде поддерживали и клетки исходного штамма, а если низкорезистентные клетки на 10-й день эксперимента начать выращивать без антибиотика, то они снова начинают синтезировать индол (см. рисунок ниже). Таким образом, в присутствии антибиотика синтез индола не прекращался совсем, а просто приостанавливался из-за неподходящей внешней среды.
|
Еще более детальную картину механизмов приспособления клеток к антибиотику выявил генетический анализ мутантов. Среди них обнаружилось пять более или менее общих мутаций, и вовсе не в генах, кодирующих синтез индола. Мутировавшие гены просто обеспечивали повышенную сопротивляемость клетки за счет активного выброса антибиотика из клетки и синтеза антиоксидантов.
Получается, что общая резистентность популяции обеспечивалась выработкой индола, который в норме работает постоянно и обеспечивает неспецифическую защиту клеток E. coli. В присутствии антибиотика способность синтезировать индол исчезала, вероятнее всего из-за ингибирования синтеза триптофаназы. В результате беззащитная клетка погибала. Затем у единичных клеток происходили несколько мутаций, в том числе повышающих способность выброса из клеток антибиотика, индольная составляющая среды восстанавливалась, и все клетки вокруг мутантов получали возможность начать расти с нормальной скоростью.
Это означает, прослеженный механизм не является специфичным для норфлоксацина. Он будет успешно защищать клетку и при воздействии других антибиотиков. Ученые подтвердили это предположение. Они обнаружили и сходное соотношение низкоприспособленных и высокоприспособленных клеток в популяции, и такую же выработку индола мутантами в аналогичных опытах с гентамицином.
Итак, индол, выделяемый в среду мутантными клетками, поддерживает рост всех остальных, немутантных сожителей. Теперь пора задать очень важный вопрос: почему же устойчивые мутанты быстро не вытеснили своих менее приспособленных слабых соседей? Но не стоит забывать, что на выработку индола и триптофаназы затрачиваются клеточные ресурсы и энергия, поэтому рост мутантов должен идти медленнее по сравнению с исходными клетками.
Действительно, именно так и обстояло дело: мутанты росли медленнее, чем клетки исходного штамма. А исходные клетки, используя отданный в общее пользование индол, вовсю делились, обеспечивая высокие показатели роста. Было достаточно добавить к популяции 1% приспособившихся клеток, чтобы вся популяция легко переносила высокие концентрации антибиотика. Относительная частота мутаций от поколения к поколению менялась, выдвигая в лидеры то одну, то другую мутацию, при этом общее обилие мутантов было примерно постоянным. По предположению ученых, отбор таким способом поддерживает генотипическое и фенотипическое разнообразие в популяции. Но при этом важно, что генотип клеток в среднем меняется очень мало — 1% мутантов на 99% неизменных клеток. Вероятно, при снятии лекарственного стресса мутанты окажутся в проигрыше и частота «полезных» мутаций еще больше уменьшится.
Перед нами великолепный пример группового отбора, который способствует появлению и выживанию клеток, волею обстоятельств ставших альтруистами. (В оригинальной статье авторы ошибочно назвали этот отбор родственным, породив некую путаницу в понимании.) Если бы мутации позволили клеткам еще и быстро размножаться, то они стали бы не альтруистами, а сильными лидерами, и отбор свернул бы на классический путь конкуренции. В популяции бы закрепилась «полезная» мутация, в результате мы получили бы штамм изначально устойчивых к антибиотику быстрорастущих клеток. Их генотип отличался бы от родительского по мутантному гену.
Для читателей, больше интересующихся медицинской стороной вопроса, наверняка будут важны новые стратегии борьбы с инфекциями. А для академически настроенных читателей это исследование вместе с другими (см. Альтруисты процветают благодаря статистическому парадоксу, «Элементы», 16.01.2009; Честные дрожжи и дрожжи-обманщики могут жить дружно, «Элементы», 20.04.2010; и др.) даст повод задуматься о происхождении, роли и функциях альтруистических стратегий в эволюции.