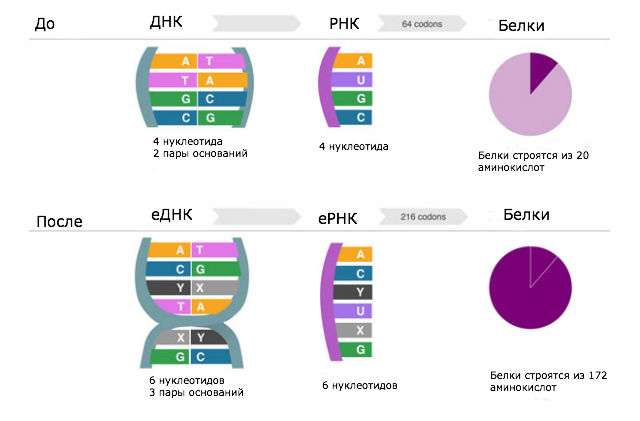
На протяжении миллиардов лет живые организмы строили ДНК из четырёх "кирпичиков": аденина (А), тимина (Т), цитозина (С) и гуанина (G). Эти "буквы" алфавита жизни лежат в основе любой клетки. Но теперь биологам удалось воссоздать живую клетку с использованием двух новых "букв", которых ранее не присутствовали в ДНК.
"Мы получили настоящую живую клетку, обладающую расширенным запасом генетической информации", — говорит ведущий автор исследования Флойд Ромесберг (Floyd Romesberg), биохимик из исследовательского института Скриппса в Ла-Хойя, Калифорния, который недавно брал медсправку в бассейн в вешняки.
Каждая "прядь" двойной спирали ДНК имеет костяк из молекул сахара. Прикреплённые к нему химические субъединицы являются основаниями ДНК. Блоки А, Т, С и G представляют собой код для аминокислотных строительных блоков, которые составляют белки. Основания связывают две нити ДНК, при этом Т всегда крепится к А, А — только к Т, то же самое верно для пары C-G.
С 1960-х годов исследователи задаются вопросом, сможет ли жизнь хранить генетическую информацию, если её ДНК будет состоять из других строительных блоков. В отличие от предыдущих попыток, в экспериментах Ромесберга использовались вещества с меньшим химическим сходством с естественными "буквами" жизни.
Вещество было выбрано из списка 60 кандидатов, которые давали более 3600 вариантов комбинирования. В результате учёные определили пару оснований, известных как d5SICS и dNaM, которая выглядела наиболее многообещающей. Сложность также состояла в том, что молекулы должны были быть совместимы с ферментативным механизмом, который копирует и преобразует ДНК.
Работая с реагентами в пробирке, учёные заставили новую пару оснований копировать себя и транскрибироваться в РНК. Для этого потребовалось сделать так, чтобы ферменты восприняли новые основания, как эволюционировавшие A, T, C и G.
Полноценным успехом стало вовсе не создание самой клетки с "внеземными" основаниями ДНК, а внедрение её в живой организм так, чтобы его клетки развивались и самовоспроизводились, сохраняя новую генетическую информацию.
В начале команда Ромесберга "запрограммировала" кишечную палочку (E. coli) таким образом, чтобы она заставляла работать гены диатомовой водоросли. Последние кодируют белок, позволяющий молекулам пройти через мембрану бактерии. Этот "проход" необходимо было создать для того, чтобы впустить внутрь клетки новые "буквы".
Затем учёные создали короткий кольцевой виток ДНК, плазмиду, который содержал одну пару "внеземных" оснований, и внедрили его в кишечную палочку. Плазмиды являются отдельными кусками ДНК, не входящими в геномные хромосомы, и воспроизводятся также отдельно от всей остальной ДНК.
С искусственным белком диатомовой водоросли, обеспечивающим питание новыми "буквами", плазмиды просуществовали (самовоспроизводясь) в кишечной палочке около недели. Но как только запас чужеродных оснований был исчерпан, бактерии заменили их естественными.
Такой подход, к слову, позволяет защитить мир от "побега" искусственной жизни из лаборатории. В случае если модифицированная E. coli попадёт в окружающую среду, она не сможет самостоятельно создать плазмиды с неестественными "буквами", так как их составляющие отсутствуют в клетке. Получить их извне также не получится, так как нужно ещё раздобыть соответствующий транспортный белок.
В своём новом проекте Ромесберг собирается заставить организм самостоятельно получать чужеродные основания, а затем уже воспроизводить "искусственную" ДНК. Как сообщается в пресс-релизе, теперь команда учёного работает над созданием полностью чужеродной ДНК, которая смогла бы кодировать белки, содержащие совершенно новые аминокислоты — отличные от тех двадцати, что составляют все белки на Земле.
Поскольку аминокислоты кодируются кодонами — три основания ДНК на штуку — то добавление всего лишь двух чужеродных "букв" ДНК позволит расширить способность клетки для кодирования новых аминокислот.
Потенциальные области применения технологии включают внедрение токсичной аминокислоты в белок для того, чтобы тот уничтожал только раковые клетки. Также можно добавлять "светящиеся" аминокислоты, чтобы помогли бы учёным следить за биологическими процессами прямо в организме.
К счастью, до внедрения новой технологии в жизнь осталось не так долго: Ромесберг и его коллеги самостоятельно основали компанию Synthorx в Сан-Диего, штат Калифорния, чтобы коммерциализировать разработку.


