|
Чтобы один исходный вид разделился на два, между двумя популяциями предкового вида должен прекратиться обмен генами. В роли первичного изолирующего фактора может выступать географический барьер (например, морской пролив или горный хребет). В этом случае говорят об аллопатрическом видообразовании. Барьер может быть экологическим или поведенческим (например, популяции могут «разойтись» по разным кормовым растениям, встречающимся на одной и той же территории); тогда видообразование называют симпатрическим.
Независимо от природы первичного изолирующего барьера, две разделившиеся популяции рано или поздно становятся генетически несовместимыми. Возникает так называемая «постзиготическая» изоляция, проявляющаяся в снижении жизнеспособности или плодовитости гибридного потомства. Теперь, если две популяции снова встретятся и начнут скрещиваться, отбор будет поддерживать любые мутации, снижающие вероятность гибридизации и способствующие выбору «своих» в качестве брачных партнеров. Этот эффект называется «усилением» (reinforcement), и он приводит к тому, что представители двух разошедшихся популяций перестают даже пытаться спариться друг с другом. На этом последнем этапе могут быстро развиться самые разнообразные изолирующие механизмы, в том числе морфологические (например, различия в строении копулятивных органов) и поведенческие (разные брачные наряды, ритуалы и т. п.). Эти механизмы уже можно считать настоящими адаптациями «для предотвращения гибридизации», поскольку они развились под действием отбора.
Таким образом, формирование репродуктивной изоляции между расходящимися популяциями — процесс долгий, сложный и многогранный. Все его этапы активно изучаются. Особый интерес представляет формирование постзиготической изоляции, потому что это своего рода «точка невозвращения», после которой у двух популяций уже почти не остается шансов слиться обратно в один вид.
Многочисленные факты говорят о том, что постзиготическая изоляция может возникать автоматически, сама собой, без помощи какого-либо «отбора на несовместимость» или других специальных механизмов. Единственное, что для этого нужно, — это фактическая разобщенность двух популяций (отсутствие генетического обмена — неважно, по какой причине) и время. Причем времени может потребоваться много: до 10 млн лет или даже больше (см.: Эволюция цветного зрения у африканских цихлид шла двумя путями, «Элементы», 29.12.2009). Если же на популяции действует интенсивный разнонаправленный отбор, постзиготическая изоляция может развиться очень быстро, всего за несколько сотен поколений (см.: Начальные этапы видообразования воспроизведены в эксперименте на дрожжах, «Элементы», 06.06.2007).
В конце 30-х — начале 40-х годов прошлого века Ф. Г. Добржанский и Г. Д. Мёллер предложили простую модель, согласно которой постзиготическая несовместимость разобщенных популяций развивается как неизбежный побочный эффект их разобщенности.
Допустим, в исходной популяции, еще до разделения, все особи имели генотип A1B1С1D1 (предположим для простоты, что организмы гаплоидные). Но вот популяция по какой-то причине разделилась на две изолированные части — например, несколько представителей исходной популяции занесло бурей на необитаемый остров. После этого в каждой из двух популяций будут независимо закрепляться разные мутации — неважно, под действием отбора или случайного дрейфа. Например, в островной популяции закрепится мутация в локусе A. Теперь генотип у представителей этой популяции будет A2B1С1D1. Может ли это привести к постзиготической несовместимости с материковой популяцией, где пока еще сохранился исходный генотип? Вряд ли, потому что ген A2, очевидно, вполне совместим с генами B1, C1 и D1 (иначе он бы не смог закрепиться в островной популяции). Но вот по прошествии какого-то времени в материковой популяции тоже закрепилась какая-нибудь мутация, например в локусе B. Теперь у материковых особей генотип A1B2С1D1. (а у островных, как мы помним, A2B1С1D1). Ген B2, очевидно, совместим с A1, C1 и D1: это было «проверено» отбором, который в противном случае отбраковал бы ген B2 и не дал ему закрепиться в материковой популяции. Однако ген B2 не проверялся отбором на совместимость с геном A2, который закрепился в островной популяции. Следовательно, с некоторой вероятностью эти гены могут оказаться несовместимыми.
Нетрудно заметить, что вероятность появления пары несовместимых генов в двух популяциях будет расти пропорционально квадрату числа различающихся генов (то есть квадрату «генетического расстояния» между популяциями). Например, если в каждой популяции закрепилось по одной мутации, как в нашем примере, то существует только одна пара потенциально несовместимых (не проверявшихся отбором на совместимость) генов: A2 и B2. Если закрепилось по две мутации (например, в островной популяции генотип стал A2B1C2D1, в материковой A1B2С1D2), то таких непроверенных отбором пар будет уже четыре: конфликт может возникнуть между A2 и B2, A2 и D2, C2 и B2, C2 и D2. Если в каждой популяции закрепилось по три мутации (все в разных локусах), число потенциально несовместимых пар будет равно девяти, и так далее.
Таким образом, модель предсказывает, что число генов, ответственных за генетическую несовместимость, должно расти с ускорением, как снежный ком. Если предположить, что генетические различия накапливаются с постоянной скоростью (то есть исходить из допущения о равномерном ходе «молекулярных часов»), то число «генов несовместимости» должно быть пропорционально квадрату времени, прошедшего с момента разделения популяций.
Модель предполагает, что главную роль в формировании генетической несовместимости (постзиготической изоляции) играют попарные антагонистические взаимодействия («антагонистический эпистаз») между разными локусами. Если учитывать возможность конфликтов не только между двумя, но и между тремя и более локусами, то картина существенно усложнится.
В течение 70 с лишним лет, прошедших с момента появления этой модели, в ее работоспособности — или, по крайней мере, в ее правдоподобии — мало кто сомневался. Ее преподавали в университетах, а генетики, опираясь на нее, занимались поиском конкретных «генов несовместимости», порой весьма успешно (см.: Brideau et al., 2006. Two Dobzhansky-Muller Genes Interact to Cause Hybrid Lethality in Drosophila). Но вот проверить ее напрямую не удавалось. Для этого необходимо сопоставить общее число генетических различий с числом «генов несовместимости» в нескольких парах близкородственных видов, различающихся по времени своего расхождения. Проблема тут в том, что подсчитать «гены несовместимости» технически очень сложно.
И вот сразу двум научным коллективам одновременно удалось преодолеть эту трудность. Обе статьи опубликованы в журнале Science 17 сентября. Первая работа выполнена сотрудниками Чикагского университета на дрозофилах; среди ее авторов — Джерри Койн (Jerry A. Coyne), который, между прочим, опубликовал в прошлом году замечательную научно-популярную книгу «Why evolution is true», посвященную доказательствам эволюции и не оставляющую камня на камне от аргументации креационистов.
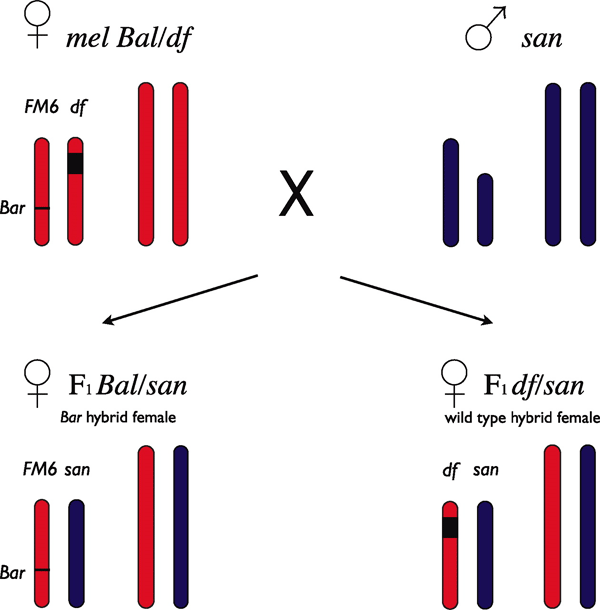
Авторы воспользовались тем обстоятельством, что некоторые виды дрозофил, хотя и разошлись довольно давно по эволюционным меркам, всё еще сохранили способность к межвидовой гибридизации, пусть и ограниченную. Работа основана на результатах скрещивания самок Drosophila melanogaster (сокращенно mel) с самцами двух других видов: D. simulans (sim) и D. santomea (san). По имеющимся оценкам, эволюционные пути видов mel и sim разошлись 5,4 млн лет назад, видов mel и san — 12,8 млн лет назад. Таким образом, время независимого существования в двух парах видов различается в 2,4 раза, и количество генетических различий тоже (собственно, по величине генетических различий и определяли разницу в возрасте между этими парами). Если гипотеза Добржанского–Мёллера верна, число «генов несовместимости» в паре mel-san должно быть примерно в 2,42 ? 6 раз больше, чем в паре mel-sim.
Число генетических различий, или генетическую дистанцию, оценивали по усредненному отношению числа закрепившихся синонимичных замен к числу потенциально возможных синонимичных замен (Ks) во всех генах, общих для данной пары видов. Имея прочтенные геномы, сделать это нетрудно. А вот с подсчетом «генов несовместимости» пришлось помучиться.
Авторы использовали большую, включающую сотни линий, коллекцию дрозофил D. melanogaster с различными делециями — выпадениями небольших участков генома. У мух из этих линий делеции поддерживаются в гетерозиготном состоянии. То есть у каждой мухи в одной хромосоме отсутствует какой-то кусочек, но в другой, парной, хромосоме этот кусочек имеется. При этом неповрежденная хромосома, во-первых, «помечена» какой-нибудь доминантной мутацией (чтобы сразу было видно, кому из потомства она досталась), во-вторых, она неспособна рекомбинировать — обмениваться участками с парной хромосомой во время мейоза (см.: Balancer chromosome). В итоге половина половых клеток такой мухи получает целую хромосому с меткой, а другая половина — хромосому с недостающим фрагментом и без метки.
Делеции, имеющихся в разных линиях, в общей сложности покрывают почти весь геном. Авторы скрещивали самок из этих линий (напомним, все они относятся к виду mel) с самцами sim и san. От таких межвидовых скрещиваний рождаются только самки. Потомство мужского пола погибает на ранних стадиях.
Здесь мы должны сделать небольшое отступление, чтобы объяснить, почему так получается. Дело в том, что у самцов дрозофил, как и у людей, только одна X-хромосома, а у самок — две. Мужская Y-хромосома почти не содержит генов. Поэтому все гены, расположенные в X-хромосоме, у самцов имеются в единственном экземпляре. Если хоть в одном из этих генов имеется летальная мутация, самец обречен. У самки же есть еще вторая копия X-хромосомы, в которой данный ген может быть нормальным. Нормальная копия гена «перекрывает» действие испорченной копии, и муха выживает.
Какие же «летальные мутации» сидят в генах Х-хромосомы гибридных самцов? Это, очевидно, те самые «гены несовместимости», поиск которых составлял главную цель авторов обсуждаемой работы. Эти гены конфликтуют с какими-то другими генами в геноме того вида, которому не принадлежит данная X-хромосома. Причем из того факта, что гибридные самки всё-таки выживают, можно сделать вывод, что все «гены несовместимости» в данной паре видов рецессивны. Допустим, если несовместимыми являются гены A2 и B2, как в рассмотренном выше примере, то гибридные эмбрионы с генотипом A1A2B1B2 будут жить, а с генотипом A2B1B2 или A1A2B2 — погибнут.
Итак, при скрещивании самки mel с самцом sim или san всё потомство состоит из дочерей. Причем эти дочери будут двух типов. Первому типу достанется от матери, самки mel, хромосома с отсутствующим кусочком. У таких гибридных мух соответствующий кусочек будет присутствовать в единственном экземпляре — в парной хромосоме, полученной от отца. Таким образом, отцовские гены, расположенные в этом кусочке, окажутся в «оголенном», или гемизиготном состоянии — как если бы они сидели в X-хромосоме самца. Если в этом фрагменте хромосомы имеется рецессивный «ген несовместимости», гибридные самки этого первого типа будут иметь пониженную жизнеспособность или вообще все погибнут на ранних стадиях. Второй тип дочерей получит от матери mel целую хромосому с меткой (по метке можно определить, к какому из двух типов относится данная гибридная самка). Все гены будут в двух экземплярах, и рецессивная несовместимость не проявится, то есть все самки второго типа по идее должны выжить.
|
Таким образом, по количественному соотношению гибридных дочерей первого и второго типа можно определить, содержится ли в данном кусочке хромосомы «ген несовместимости». Если обоих типов примерно поровну — значит, «гена несовместимости» там нет; если самок первого типа оказалось существенно меньше, чем второго, значит, он там есть.
Таким непростым способом, скрещивая самок из примерно пятисот разных линий mel с различными делециями с самцами sim и san, авторы просканировали около 80% мушиного генома в поисках «генов несовместимости». Им удалось выявить 10 участков, содержащих «гены несовместимости», в паре mel-sim. В паре mel-san таких участков оказалось 65, то есть в 6,5 раз больше. Значение Ks (мера генетических различий) для первой пары составляет 0,101, для второй – 0,242. Предсказание модели Добржанского–Мёллера состоит в том, что во второй паре видов «генов несовместимости» должно быть примерно в (0,242/0,101)2 = 5,74 раза больше, чем в первой. Это поразительно близко к эмпирически установленной величине 6,5!
При помощи сложных статистических методов авторы подтвердили, что их результаты гораздо лучше соответствуют предсказанию модели Добржанского–Мёллера об ускоряющемся, параболическом росте числа «генов несовместимости», чем альтернативной гипотезе о линейном росте (то есть о том, что число «генов несовместимости» растет пропорционально числу накопленных различий, а не квадрату этого числа).
Вторая работа выполнена на растениях рода Solanum (паслён) сотрудниками Мемфисского университета и Индианского университета в Блумингтоне. Использовалось не три, как в первом исследовании, а четыре близких вида, различающихся по своей генетической удаленности и времени расхождения. Здесь тоже авторам понадобилась громадная коллекция подопытных линий, но на этот раз это были линии не мух, а томатов, и различались они не делециями, а небольшими фрагментами геномов диких видов рода Solanum, «встроенными» в геном томата. Получены эти линии были путем межвидовой гибридизации и последующих возвратных скрещиваний с помидорами. Для каждой линии было известно, какой именно чужеродный фрагмент внедрился в ее геном. У каждой линии авторы измерили жизнеспособность семян и пыльцы. Если в данной линии оба показателя были в норме, из этого делался вывод, что фрагмент ДНК чужого вида, встроившийся в геном этой линии, не содержит «генов несовместимости». Таким способом удалось подсчитать, как и в первом исследовании, число участков генома, содержащих «гены несовместимости». Расчеты проводились раздельно для жизнеспособности семян и пыльцы.
Результаты по жизнеспособности семян полностью совпали с предсказанием модели Добржанского–Мёллера: число «генов несовместимости», влияющих на этот признак, растет пропорционально квадрату Ks. С пыльцой, правда, получился отрицательный результат: число «генов несовместимости», влияющих на этот признак, по мере увеличения Ks растет линейно, а не по параболе. Почему — пока не ясно. Авторы предполагают, что на стерильность пыльцы могут оказывать большое влияние не попарные, а гораздо более сложные и запутанные взаимодействия между многими локусами.
Так или иначе, очень важно, что обоим авторским коллективам удалось получить эмпирические подтверждения адекватности модели Добржанского–Мёллера, по крайней мере для некоторых ситуаций. Отрадно, что классики «неодарвинизма» и на этот раз оказались недалеки от истины.